A transformação da matéria é o objeto de estudo da Química, então os químicos precisam usar grandezas e unidades de medidas apropriadas. As principais são: massa atômica, massa molecular, número de Avogadro, mol e massa molar. Leia nosso resumo e treine com os 5 Melhores Exercícios de Grandezas Químicas com gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- O que são Grandezas Químicas?
- Quais são as Grandezas Químicas?
- Resumo em Mapa Mental!
- Lista de exercícios sobre Grandezas Químicas!
- Respostas dos exercícios de Grandezas Químicas.
Quando você terminar os exercícios sobre Grandezas Químicas, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que são Grandezas Químicas?
As grandezas químicas são os valores de referência que os químicos usam para medir cada elemento.
Isso porque a Química estuda a transformação da matéria, então é necessário usar unidades de medidas apropriadas em cada situação!
Quais são as Grandezas Químicas?
As principais grandezas utilizadas são:
- Massa atômica;
- Massa molecular;
- Número de Avogadro;
- Mol;
- Massa molar.
A seguir, vamos conhecer a explicação de cada uma delas:
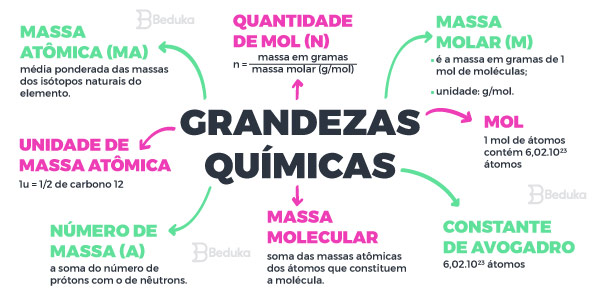
Massa atômica
Massa atômica é a quantidade de massa que um átomo de um determinado elemento químico possui.
A massa do átomo é muito pequena para ser expressa em miligramas ou gramas, por isso, os químicos definiram uma nova grandeza denominada de unidade de massa atômica (u).
Os químicos resolveram usar um valor padrão para determinar a unidade de massa atômica (u) que equivale a 1/12 da massa do isótopo do carbono que possui um número de massa igual a 12 (12C).
A partir disso, a massa atômica ficou definida como a massa do átomo medida em unidades de massa atômica (u) que indica quantas vezes sua massa é maior que 1/12 do 12C.
Massa Molecular
Massa Molecular é o somatório das massas atômicas (u) dos átomos que formam uma determinada molécula.
Mol
O mol é a grandeza que representa a quantidade de matéria existente. A massa que está contida em 1 mol é denominada de massa molar.
1 mol é igual a 6,02 x 10²³ entidades
Entidades podem ser qualquer matéria. Ferro, ouro, açúcar, sal, qualquer coisa que possua matéria pode ser quantificado em mols.
Número de Avogadro
O número de Avogadro representa o número de moléculas ou partículas contidas em um moL.
Massa Molar
A Massa Molar (M) é a massa de 6,02 x 10²³ entidades que é expressa em g/mol.
A massa molecular e a massa molar possuem os mesmos valores, o que as difere é a unidade de medida. A massa molar relaciona-se com o número de mols que é dado pela constante de Avogadro.
Resumo de Grandezas Químicas em Mapa Mental!
- São mais de 200 resumos no Instagram do Beduka!
Exercícios sobre Grandezas Químicas com Gabarito
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (Fuvest-SP)
A tabela abaixo apresenta o mol, em gramas, de várias substâncias:
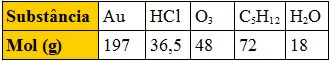
Tabela com mol de substâncias
Comparando massas iguais dessas substâncias, a que apresenta maior número de moléculas é:
a) Au.
b) HCl.
c) O3.
d) C5H10.
e) H2O.
Questão 2 – (Unicid-SP)
Um químico possui uma amostra de cobre (dado: 6429Cu). A massa, em gramas, dessa amostra, sabendo-se que ela é constituída por 3,01 . 1023 átomos, é:
a) 0,32 . 1023 g.
b) 0,29 . 1023 g.
c) 1,60 . 1023 g.
d) 64,00 g.
e) 32,00 g.
Questão 3 – (UNESP)
Na Natureza, de cada 5 átomos de boro, 1 tem massa atômica igual a 10 u.m.a (unidade de massa atômica) e 4 têm massa atômica igual a 11 u.m.a. Com base nestes dados, a massa atômica do boro, expressa em u.m.a, é igual a:
a) 10.
b) 10,5.
c) 10,8.
d) 11.
e) 11,5.
- Você está indo muito bem! Faça os 2 últimos exercícios de Grandezas Químicas
Questão 4 – (FUVEST)
A dose diária recomendada do elemento cálcio para um adulto é de 800 mg. Suponha certo suplemento nutricional a base de casca de ostras que seja 100% CaCO3. Se um adulto tomar diariamente dois tabletes desse suplemento de 500 mg cada, qual porcentagem de cálcio da quantidade recomendada essa pessoa está ingerindo?
massas molares (g/mol)
Ca ……………………… 40
O ……………………….. 16
C ……………………….. 12
a) 25%.
b) 40%.
c) 50%.
d) 80%.
e) 125%.
Questão 5 – (Fuvest-SP)
O Brasil produz, por ano, aproximadamente, 5,0×106 toneladas de ácido sulfúrico (H2SO4), 1,2×106 toneladas de amônia (NH3) e 1,0×106 toneladas de soda cáustica (NaOH). Transformando tonelada em mols, a ordem decrescente de produção dessas substâncias será.
(H= 1g/mol; S= 32 g/mol; N= 14 g/mol; Na= 23 g/mol e O= 16 g/mol).
a) H2SO4 > NH3 > NaOH.
b) H2SO4 > NaOH > NH3.
c) NH3 > H2SO4 > NaOH.
d) NH3 > NaOH > H2SO4.
e) NaOH > NH3 > H2SO4.
- Parabéns, você chegou ao fim dos exercícios de Grandezas Químicas. Confira agora o Gabarito:
Gabarito dos Exercícios de Grandezas Químicas
Exercício resolvido da questão 1 –
Alternativa correta: e) H2O.
Exercício resolvido da questão 2 –
Alternativa correta: e) 32,00 g.
Exercício resolvido da questão 3 –
Alternativa correta: c) 10,8.
Exercício resolvido da questão 4 –
Alternativa correta: c) 50%.
Exercício resolvido da questão 5 –
Alternativa correta: c) NH3 > H2SO4 > NaOH.
Gostou dos nossos Exercícios de Grandezas Químicas? Compartilhe com os seus amigos e comente abaixo sobre as áreas que você deseja mais explicações.
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.





