As Leis Ponderais são afirmações sobre o comportamento das massas em experimentos com reações químicas. Lavoisier, Proust e Dalton foram cientistas que elaboraram cada uma das 3 leis, envolvendo razão e proporção. Leia nosso resumo e treine com os 8 Melhores exercícios de Leis Ponderais com gabarito!
No ano de 2019, a indústria farmacêutica faturou cerca de 158 bilhões de dólares. Muito dinheiro, né? Isso ilustra como a sociedade mundial consome uma quantidade enorme de remédios.
O processo de fabricação de medicamentos é muito complexo e delicado. As doses de cada substâncias devem ser perfeitamente calculadas. E é aí que entra o nosso tema… As Leis Ponderais são a base teórica desse cálculo!
Neste artigo, você encontrará todos os tópicos abaixo. Clique em um dos títulos para ir direto ao assunto:
- O que são Leis Ponderais?
- Quais são as 3 Leis Ponderais?
- Lista de exercícios sobre Leis Ponderais!
- Respostas dos exercícios de Leis Ponderais.
Quando você terminar os exercícios sobre Leis Ponderais, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.

O que são Leis Ponderais? (RESUMO)
As Leis Ponderais são um conjunto de 3 afirmativas sobre o comportamento das massas durante as reações químicas.
Reações químicas são ações que ocorrem entre duas ou mais substâncias e dão origem a diferentes compostos.
Elas são representadas de forma genérica como uma equação em que reagentes aparecem no primeiro membro e os produtos no segundo.
A + B → C + D
- A e B antes da seta são aqueles compostos iniciais que promovem a reação, por isso são chamados de reagentes.
- A seta indica o sentido da reação.
- As substâncias C e D são originadas a partir de A e B, por isso são chamadas de produtos.
Os experimentos foram feitos com diversas reações químicas. Então, observou-se padrões de comportamento que podiam ser descritos com cálculos que envolvem proporção e razão.
Quando são observadas nos volumes das substâncias, referem-se à Lei de Gay Lussac ou Leis Volumétricas.
Quando esse cálculo é observado nas massas das substâncias, são chamadas de Leis Ponderais.
- São mais de 200 resumos no Instagram do Beduka!
Quais são as 3 leis ponderais?
As Leis Ponderais são 3 leis que surgiram no final do Século XVIII e contou com a participação de vários químicos e estudiosos da época.
As três Leis ponderais mais famosas são:
- Lei de Lavoisier ou Lei da Conservação de Massas;
- Lei de Proust ou Lei das Proporções Definidas;
- Lei de Dalton ou Lei das Proporções Múltiplas.
Cada uma dessas leis recebe o nome do cientista que realizou o experimento decisivo para a confirmação.
- Você precisa relembrar o que diz cada lei? Veja nosso artigo completo sobre as Leis Ponderais!
Exercícios sobre Leis Ponderais com Gabarito
Com esse resumo, esperamos que tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (FCMSC-SP)
A frase: “Do nada, nada; em nada, nada pode transformar-se” relaciona-se com as ideias de:
a) Dalton.
b) Proust.
c) Boyle.
d) Lavoisier.
e) Gay-Lussac.
Questão 2 – (UFMG)
Considere as seguintes reações químicas, que ocorrem em recipientes abertos, colocados sobre uma balança:
I – Reação de bicarbonato de sódio com vinagre, em um copo.
II – Queima de álcool, em um vidro de relógio.
III – Enferrujamento de um prego de ferro, colocado sobre um vidro de relógio.
IV – Dissolução de um comprimido efervescente, em um copo com água.
Em todos os exemplos, durante a reação química, a balança indicará uma diminuição da massa contida no recipiente, exceto em:
a) III.
b) IV.
c) I.
d) II.
- Você já fez 25% das questões sobre Leis Ponderais. Vamos lá!
Questão 3 – (Fuvest-SP)
Os pratos A e B de uma balança foram equilibrados com um pedaço de papel em cada prato e efetuou-se a combustão apenas do material contido no prato A. Esse procedimento foi repetido com palha de aço em lugar de papel. Após cada combustão, observou-se:

Com papel Com palha de aço
a) A e B no mesmo nível. A e B no mesmo nível.
b) A abaixo de B. A abaixo de B.
c) A acima de B. A acima de B.
d) A acima de B. A abaixo de B.
e) A abaixo de B. A e B no mesmo nível.
Questão 4 – (FUVEST/SP)
O conjunto esquematizado contém inicialmente os reagentes A e B separados. Utilizando dois conjuntos desse tipo, são realizados os experimentos 1 e 2, misturando-se A e B, conforme descrito a seguir:
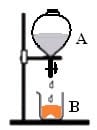
Experimento 1:
Reagente A: solução aquosa de nitrato de prata.
Reagente B: pó de cloreto de sódio.
Produtos: cloreto de prata sólido e solução aquosa de nitrato de sódio.
Experimento 2:
Reagente A: solução aquosa de cloreto de hidrogênio.
Reagente B: pó de carbonato de sódio.
Produtos: água líquida, gás carbônico e solução aquosa de cloreto de sódio.
Designando por I a massa inicial de cada conjunto (antes da mistura) e por F1 e F2 suas massas finais (após misturar) tem-se:
a) Experimento 1: F1 = I; experimento 2: F2 = I.
b) Experimento 1: F1 = I; experimento 2: F2 > I.
c) Experimento 1: F1 = I; experimento 2: F2 < I.
d) Experimento 1: F1 > I; experimento 2: F2 > I.
e) Experimento 1: F1 < I; experimento 2: F2 < I.
- Você está indo muito bem! Chegamos à metade dos exercícios sobre Leis Ponderais.
Questão 5 – (Fuvest-SP)
Quando 96 g de ozônio se transformam completamente, a massa de oxigênio comum produzida é igual a:
a) 32 g.
b) 48 g.
c) 64 g.
d) 80 g.
e) 96 g.
Questão 6 – (Mack-SP)
Uma mistura de 1,5 mol de gás carbônico, 8 g de metano (16 g/mol) e 44,8 L de monóxido de carbono está contida em um balão de 30 L nas CNTP. É correto dizer que
Dado: volume molar nas CNTP = 22,4 L/mol.
a) a pressão parcial do monóxido de carbono é o dobro da do metano.
b) a pressão parcial do metano é o triplo da do gás carbônico.
c) a pressão do gás carbônico é 1/4 da do monóxido de carbono.
d) a pressão parcial do monóxido de carbono é o quádruplo da do metano.
e) a pressão total é igual a 4 atm.
- Só faltam mais duas questões sobre Leis Ponderais! Continue!
Questão 7 – (PUC-RIO 2007)
As reações químicas podem ser classificadas de acordo com as suas especificidades.
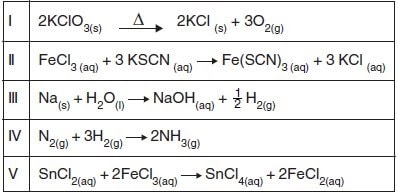
A respeito das equações acima, numeradas de I a V, está correto afirmar que a reação:
a) I é de síntese ou adição.
b) II é de oxirredução.
c) III é de simples troca ou deslocamento.
d) IV é de análise ou decomposição.
e) V é de dupla troca.
Questão 8 – (UFF 2009)
Desde a Antigüidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas, descobriram elementos e sintetizaram substâncias que passaram a ser usadas como medicamentos. No século XVIII, a Química, a exemplo da Física, torna-se uma ciência exata. Lavoisier iniciou na Química o método científico, estudando os porquês e as causas dos fenômenos. Assim, descobriu que as transformações químicas e físicas ocorrem com a conservação da matéria. Outras leis químicas também foram propostas e, dentre elas, as ponderais, ainda válidas. Com base nas leis ponderais, pode-se afirmar que, segundo:
I. a Lei da Conservação da Massa (Lavoisier), 1,0 g de Ferro ao ser oxidado pelo Oxigênio, produz 1,0 g de Óxido Férrico;
II. a Lei da Conservação da Massa, ao se usar 16,0 g de Oxigênio molecular para reagir completamente com 40,0 g de Cálcio, são produzidas 56g de Óxido de Cálcio;
III. a Lei das Proporções Definidas, se 1,0g de Ferro reage com 0,29 g de Oxigênio para formar o composto Óxido Ferroso, 2,0 g de Ferro reagirão com 0,87 g de Oxigênio, produzindo o mesmo composto;
IV. a Lei das Proporções Múltiplas, dois mols de Ferro reagem com dois mols de Oxigênio para formar Óxido Ferroso; logo, dois mols de Ferro reagirão com três mols de Oxigênio para formar Óxido Férrico.
Assinale a opção correta.
a) As afirmativas I e II estão corretas.
b) A afirmativa II está correta.
c) As afirmativas II e III estão corretas.
d) As afirmativas II e IV estão corretas.
- Parabéns, você chegou ao fim dos exercícios de Leis Ponderais. Confira agora o Gabarito:
Gabarito dos Exercícios de Leis Ponderais
Exercício resolvido da questão 1 –
Alternativa correta: d) Lavoisier.
Exercício resolvido da questão 2 –
Alternativa correta: a) III.
Exercício resolvido da questão 3 –
Alternativa correta: d) A acima de B // A abaixo de B.
Exercício resolvido da questão 4 –
Alternativa correta: c) Experimento 1: F1 = I; experimento 2: F2 < I.
Exercício resolvido da questão 5 –
Alternativa correta: e) 96 g.
Exercício resolvido da questão 6 –
Alternativa correta: d) a pressão parcial do monóxido de carbono é o quádruplo da do metano.
Exercício resolvido da questão 7 –
Alternativa correta: c) III é de simples troca ou deslocamento.
Exercício resolvido da questão 8 –
Alternativa correta: d) As afirmativas II e IV estão corretas.
Gostou dos nossos Exercícios de Leis Ponderais? Compartilhe com os seus amigos e comente abaixo sobre as áreas que você deseja mais explicações.
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender!





