A Lei Volumétrica de Gay-Lussac é uma das principais relações matemáticas na química. Ela descreve o comportamento dos gases e líquidos, quando a condição de pressão e temperatura são constantes. Leia o resumo e teste os seus conhecimentos com os melhores exercícios de Leis Volumétricas! O gabarito está logo ao final!
Neste artigo, você encontrará todos os tópicos abaixo. Clique em um deles para ir diretamente ao tema:
- O que são Leis volumétricas?
- Quais são as 3 Leis Volumétricas?
- O que diz a Lei Geral dos Gases?
- Os 6 exercícios sobre Leis Volumétricas.
- Gabarito dos exercícios de Leis Volumétricas!
Quando você terminar as Questões de Leis Volumétricas, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que são as Leis volumétricas?
As Leis Volumétricas são um conjunto de relações matemáticas sobre o comportamento dos volumes durante as reações químicas. Por esse motivo, elas tratam de situações que costumam envolver gases e líquidos.
Alguns cientistas estudaram essas reações e viram que existia um certo padrão de comportamento em situações específicas.
Esses padrões podem ser traduzidos em linguagem matemática e é isso que vamos estudar agora!
Reações químicas são um conjunto de processos que acontecem entre duas ou mais substâncias. Elas dão origem a diferentes compostos químicos e são representadas com uma equação: A + B → C + D.
Os Reagentes (A e B) são as substâncias que serão rearranjadas para formar produtos. Elas aparecem no primeiro membro da equação.
Os Produtos (C e D) são as substâncias formadas a partir dos reagentes. Elas aparecem no segundo membro da equação. E podem formar 1 ou mais produtos.
- Quer conhecer ainda mais? Leia nosso Artigo Completo sobre Leis Volumétricas.
Quais são as Leis Volumétricas?
Existem 3 Leis Volumétricas, são elas:
- 1ͣ Lei de Gay Lussac (Lei da Combinação de Volumes);
- Lei de Charles;
- Lei de Avogadro.
Vamos entender cada uma delas nos próximo tópicos!
- São mais de 200 resumos no Instagram do Beduka!
Lei Volumétrica de Gay-Lussac
Gay Lussac produziu água a partir da reação dos gases de hidrogênio e oxigênio. Durante essas tentativas, observou que as substâncias sempre reagiam em uma mesma proporção. A partir daí, formulou a Lei da Combinação de Volumes.
Vamos supor que uma reação química entre os gases hidrogênio e oxigênio forme vapor de água. Ela deve ser feita em um ambiente que mantenha sua temperatura e pressão estáveis (sem mudar).
De acordo com as tentativas, podemos montar a tabela indicando os experimentos e seus resultados:
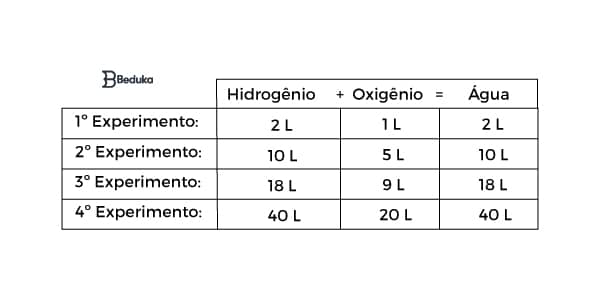
Observe que em todos os experimentos existe uma proporção de volumes dada por 2 : 1 : 2.
Para observar esse padrão, basta simplificar os volumes encontrando um denominador comum entre eles. Exemplo:
No 2° experimento, os volumes são 10 , 5 e 10. O MDC (máximo divisor comum) desses valores é o 5. Dividindo cada um desses números por 5, chegamos em 2, 1 e 2. Portanto, nessa reação química, a proporção dos volumes é formada por números inteiros e pequenos (2 e 1).
Em cada reação, sempre há uma relação desse tipo entre os volumes. Porém, a proporção pode ser dada por outros números de acordo com quem reage.
Observe este outro exemplo para entender:
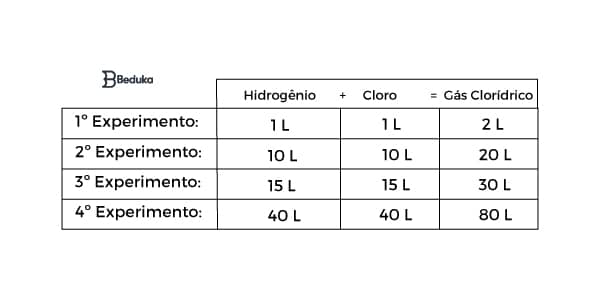
Ao realizar as contas seguindo o modelo do anterior, concluirá que a proporção que define a quantidade de gás clorídrico formada é 1 : 1 : 2.
O MDC entre 10 e 20 é 10, logo, 10/10 =1 e 20/10 = 2. Chegamos à: 1 : 1 : 2.
Lei de Avogadro
Ao comparar volumes iguais de gases diferentes, eles sempre terão a mesma quantidade de moléculas se estiverem em um ambiente com a mesma pressão e mesma temperatura.
A partir disso, ele criou o número de Avogadro, algo essencial na Química e na compreensão das Leis Ponderais.
Lei de Charles
A 2ª e a 3° Leis de Gay-Lussac também podem ser chamadas de Lei de Charles. Elas receberam essa variedade de nomes porque contaram com a participação do cientista francês Jacques Alexandre Cesar Charles.
Lei das Transformações Isocóricas: a temperatura dos gases aumenta proporcionalmente à pressão aplicada em um ambiente de volume constante.
Lei das Transformações Isobáricas: a temperatura dos gases em situações de pressão constante, aumenta ou diminui de acordo com a variação do volume
O que diz a lei geral dos gases?
A Lei geral dos gases ou Lei combinada dos gases é a síntese de tudo o que estudamos nas Leis volumétricas e na Termodinâmica dos gases. Ela combina as leis de Boyle, Charles e Gay-Lussac.
Resumindo, pode ser definida pela equação geral dos gases ideais:
P.V = n.r.T
Em que:
- P = Pressão em atm
- V = volume em L
- n = número de mols
- r = constante dos gases ideais
- T = temperatura em K°
Exercícios de Leis Volumétricas com Gabarito
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Obrigado por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (UFES)
Num sistema a uma determinada pressão e temperatura, dois gases, A e B, inodoros e incolores, reagem entre si na proporção de 1 volume de A para 3 volumes de B, gerando 2 volumes de um gás irritante, C.
Quando 3 volumes do gás A e 6 volumes do gás B forem submetidos às mesmas condições, o volume final do sistema será:
a) 2 volumes.
b) 3 volumes.
c) 5 volumes.
d) 8 volumes.
e) 9 volumes.
Questão 2 – (PUC-PR)
Aplicando a Lei de Gay-Lussac, das combinações em volume, qual a contração em volume experimentada na seguinte reação, mantendo-se constantes as condições de pressão e temperatura para os reagentes e produtos, todos gasosos?
N2 + 3 H2 → 2 NH3
a) 100%.
b) 60%.
c) 50%.
d) 30%.
e) 20%.
Questão 3 – (UFES)
Num sistema a uma determinada pressão e temperatura, dois gases, A e B, inodoros e incolores, reagem entre si na proporção de 1 volume de A para 3 volumes de B, gerando 2 volumes de um gás irritante, C.
Quando 3 volumes do gás A e 6 volumes do gás B forem submetidos às mesmas condições, o volume final do sistema será:
a) 2 volumes.
b) 3 volumes.
c) 5 volumes.
d) 8 volumes.
e) 9 volumes.
- Muito bem! Você chegou à metade dos Exercícios de Leis Volumétricas.
Questão 4 – (PUC-PR)
Aplicando a Lei de Gay-Lussac, das combinações em volume, qual a contração em volume experimentada na seguinte reação, mantendo-se constantes as condições de pressão e temperatura para os reagentes e produtos, todos gasosos?
a)100%.
b) 60%.
c) 50%.
d) 30%.
e) 20%.
Questão 5 – (UFAM)
Um sistema composto pela mistura de três gases, A, B e C, está a uma temperatura de 27ºC e apresenta uma pressão de 4 atm. Considerando que o volume total do sistema seja 37 litros e que os gases A e B apresentam respectivamente pressões parciais 2 e 1 atm, a quantidade de matéria dos gases A, B, e C é, respectivamente:
Dado: R = 0,082 atm . L . mol-1 . K-1.
a) 0,5mol; 0,25mol; 0,25mol.
b)3,0mols; 2,0mols; 1;0mol.
c)33mols; 16mols; 16mols.
d)3,0mols; 1,5mols; 1,5mols.
e)1,5 mols; 3,0 mols; 1,5 mols.
Questão 6 – (Mack-SP)
Uma mistura de 1,5 mol de gás carbônico, 8 g de metano (16 g/mol) e 44,8 L de monóxido de carbono está contida em um balão de 30 L nas CNTP. É correto dizer que
Dado: volume molar nas CNTP = 22,4 L/mol.
a) a pressão parcial do monóxido de carbono é o dobro da do metano.
b) a pressão parcial do metano é o triplo da do gás carbônico.
c) a pressão do gás carbônico é 1/4 da do monóxido de carbono.
d) a pressão parcial do monóxido de carbono é o quádruplo da do metano.
e) a pressão total é igual a 4 atm.
- Parabéns, você fez todas os Exercícios sobre Leis Volumétricas, Confira agora o Gabarito:
Gabarito dos Exercícios de Leis Volumétricas
Exercício resolvido da questão 1 –
Alternativa correta: c) 5 volumes.
Exercício resolvido da questão 2 –
Alternativa correta: c) 50%.
Exercício resolvido da questão 3 –
Alternativa correta: c) 5 volumes.
Exercício resolvido da questão 4 –
Alternativa correta: c) 50%.
Exercício resolvido da questão 5 –
Alternativa correta: d)3,0mols; 1,5mols; 1,5mols.
Exercício resolvido da questão 6 –
Alternativa correta: d) a pressão parcial do monóxido de carbono é o quádruplo da do metano.
Gostou dos nossos exercícios de Leis Volumétricas? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





