Solubilidade é grandeza que mede o quão solúvel uma coisa é. Na química, é a substância (soluto) capaz de se dissolver ao ter contato com outra substância (solvente). Essa mistura pode ser: saturada, insaturada e supersaturada. Leia nosso resumo e treine com os melhores exercícios de Solubilidade, com gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- O que é Solubilidade?
- O que é Coeficiente de Solubilidade?
- O que é Produto de Solubilidade?
- Lista de exercícios de Solubilidade!
- Respostas dos exercícios sobre de Solubilidade.
Quando você terminar as questões sobre Solubilidade, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que é Solubilidade?

A solubilidade é a capacidade que uma substância possui de se dissolver ou não dentro de determinados líquidos.
- Aqueles produtos que possuem a capacidade de dissolver são chamados de solutos.
- Já o solvente é a substância na qual o soluto será dissolvido.
A dissolução química é definida como o processo de dispersão do soluto em um determinado solvente. Como consequência, surge uma solução ou mistura homogênea.
Os solutos podem ser classificados em três tipos:
- Solúvel: solutos que são dissolvidos pelo solvente.
- Pouco Solúvel: solutos que se dissolvem com dificuldade no solvente.
- Insolúvel: solutos que não são dissolvidos pelos solvente.
Dentro da matéria de solubilidade, existe um princípio: “semelhante dissolve semelhante”.
Dessa forma, um soluto polar tem maior probabilidade de se dissolver em um solvente polar (as moléculas constituintes apresentam regiões eletronicamente densas).
O mesmo ocorre com as substâncias apolares (ausência de regiões eletricamente densas nas moléculas constituintes).
O que é Coeficiente de Solubilidade?
O coeficiente de solubilidade (Cs) é um valor constante que determina a capacidade máxima que o soluto tem de se dissolver no solvente. Cada condição de temperatura e pressão pode gerar uma nova constante.
Em outras palavras, o coeficiente de solubilidade é a quantidade exata de soluto capaz de saturar uma quantidade padrão de solvente.
Quando o solvente atinge o limite máximo de solubilidade e a quantidade máxima de concentração, denominamos de ponto de saturação.
Já o corpo de fundo ou precipitado é aquele soluto que fica depositado no fundo do recipiente.
- São mais de 200 resumos no Instagram do Beduka!
O que é Produto de Solubilidade?
O produto de solubilidade (Kps) é uma constante de equilíbrio que permite determinar qual é o tipo de solução formado.
Existem as soluções saturadas, insaturadas e saturadas com precipitado ou supersaturada. Veja só:
- Saturada: limite da saturação, ou seja, o soluto está na quantidade exata do coeficiente de solubilidade.
- Insaturada: a quantidade de soluto é menor do que o coeficiente de solubilidade.
- Supersaturada: a quantidade de soluto é maior do que o coeficiente de solubilidade.
Entenda como funciona a curva de solubilidade e quais são as suas principais características.
Exercícios de Solubilidade
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (FMU-FIAM-FAAM-SP)
Os frascos contêm soluções saturadas de cloreto de sódio (sal de cozinha).
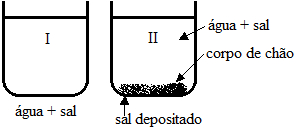
Diferentes soluções em exercícios sobre solubilidade e saturação
Podemos afirmar que:
a) a solução do frasco II é a mais concentrada que a solução do frasco I.
b) a solução do frasco I possui maior concentração de íons dissolvidos.
c) as soluções dos frascos I e II possuem igual concentração.
d) se adicionarmos cloreto de sódio à solução I, sua concentração aumentará.
e) se adicionarmos cloreto de sódio à solução II, sua concentração aumentará.
Questão 2 – (UFRS)
Quais são as soluções aquosas contendo uma única substância dissolvida que podem apresentar corpo de fundo dessa substância?
a) saturadas e supersaturadas.
b) somente as saturadas.
c) insaturadas diluídas.
d) somente as supersaturadas.
e) insaturadas concentradas.
- Você já fez 20% dos exercícios de Solubilidade. Continue assim!
Questão 3 – (PUC SP)
A uma solução de cloreto de sódio foi adicionado um cristal desse sal e verificou-se que não se dissolveu, provocando, ainda, a formação de um precipitado. Pode-se inferir que a solução original era:
a) estável.
b) diluída.
c) saturada.
d) concentrada.
e) supersaturada.
Questão 4 – (Unifesp)
Uma solução com 14 g de cloreto de sódio dissolvidos em 200 mL de água foi deixada em um frasco aberto, a 30°C. Após algum tempo, o soluto começou a ser cristalizado. Qual volume mínimo e aproximado, em mL, de água deve ter evaporado quando se iniciou a cristalização? Dados: solubilidade, a 30°C, do cloreto de sódio = 35 g/100 g de água; densidade da água a 30°C = 1,0 g/mL.
a) 20.
b) 40.
c) 80.
d) 100.
e) 160.
Questão 5 – (Unip)
Evapora-se completamente a água de 40 g de solução de nitrato de prata, saturada, sem corpo de fundo, e obtêm-se 15 g de resíduo sólido. O coeficiente de solubilidade do nitrato de prata para 100 g de água na temperatura da solução inicial é:
a) 25 g.
b) 30 g.
c) 60 g.
d) 15 g.
e) 45 g.
- Muito bem! Você está na metade das questões de Solubilidade!
Questão 6 – (UFMG)
Seis soluções aquosas de nitrato de sódio (NaNO3), numeradas de I a VI, foram preparadas em diferentes temperaturas dissolvendo-se diferentes massas de NaNO3 em 100 g de água. Em alguns casos, o NaNO3não se dissolveu completamente. Este gráfico representa a curva de solubilidade de NaNO3 em função da temperatura. Os seis pontos correspondem aos sistemas preparados:
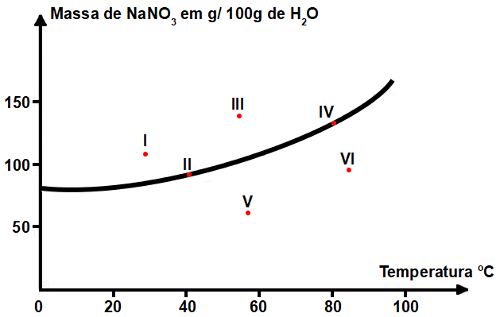
A partir da análise desse gráfico, é CORRETO afirmar que os dois sistemas em que há precipitado são:
a) I e II.
b) I e III.
c) IV e V.
d) V e VI.
Questão 7 – (Vunesp-2002)
A poluição térmica, provocada pela utilização de água de rio ou mar para refrigeração de usinas termoelétricas ou nucleares, vem do fato da água retornar ao ambiente em temperatura mais elevada que a inicial. Este aumento de temperatura provoca alteração do meio ambiente, podendo ocasionar modificações nos ciclos de vida e de reprodução e, até mesmo, a morte de peixes e plantas. O parâmetro físico-químico alterado pela poluição térmica, responsável pelo dano ao meio ambiente, é:
a) a queda da salinidade da água.
b) a diminuição da solubilidade do oxigênio na água.
c) o aumento da pressão de vapor da água.
d) o aumento da acidez da água, devido a maior dissolução de dióxido de carbono na água.
e) o aumento do equilíbrio iônico da água.
Questão 8 – (Mack-2004)
Um exemplo típico de solução supersaturada é:
a) água mineral natural.
b) soro caseiro.
c) refrigerante em recipiente fechado.
d) álcool 46°GL.
e) vinagre.
- Ufa, estamos quase lá! Faça os dois últimos exercícios de Solubilidade!
Questão 9 – (Unifesp-2004)
A lactose, principal açúcar do leite da maioria dos mamíferos, pode ser obtida a partir do leite de vaca por uma seqüência de processos. A fase final envolve a purificação por recristalização em água. Suponha que, para esta purificação, 100kg de lactose foram tratados com 100L de água, a 80°C, agitados e filtrados a esta temperatura. O filtrado foi resfriado a 10°C. Solubilidade da lactose, em kg/100L de H2O:
a 80°C ……………… 95
a 10°C ……………… 15
A massa máxima de lactose, em kg, que deve cristalizar com este procedimento é, aproximadamente,
a) 5.
b) 15.
c) 80.
d) 85.
e) 95.
Questão 10 – (Vunesp-2005)
Há décadas são conhecidos os efeitos da fluoretação da água na prevenção da cárie dentária. Porém, o excesso de fluoreto pode causar a fluorose, levando, em alguns casos, à perda dos dentes. Em regiões onde o subsolo é rico em fluorita (CaF2), a água subterrânea, em contato com ela, pode dissolvê-la parcialmente. Considere que o VMP (Valor Máximo Permitido) para o teor de fluoreto (F– ) na água potável é 1,0mg x L –1 e que uma solução saturada em CaF2, nas condições normais, apresenta 0,0016% em massa (massa de soluto/massa de solução) deste composto, com densidade igual a 1,0g x cm– 3 .
Dadas as massas molares, em g x mol–1 , Ca = 40 e F = 19, é correto afirmar que, nessas condições, a água subterrânea em contato com a fluorita:
a) nunca apresentará um teor de F– superior ao VMP.
b) pode apresentar um teor de F– até cerca de 8 vezes maior que o VMP.
c) pode apresentar um teor de F– até cerca de 80 vezes maior que o VMP.
d) pode apresentar um teor de F– até cerca de 800 vezes maior que o VMP.
e) pode apresentar valores próximos a 10–1mol x L –1 em F.
- Parabéns, você fez todos os exercícios sobre Solubilidade!
Gabarito dos exercícios sobre Solubilidade
Exercício resolvido da questão 1 –
Alternativa correta: c) as soluções dos frascos I e II possuem igual concentração.
Exercício resolvido da questão 2
Alternativa correta: b) somente as saturadas.
Exercício resolvido da questão 3
Alternativa correta: e) supersaturada.
Exercício resolvido da questão 4
Alternativa correta: e) 160.
Exercício resolvido da questão 5
Alternativa correta: c) 60 g.
Exercício resolvido da questão 6
Alternativa correta: b) I e III.
Exercício resolvido da questão 7
Alternativa correta: b) a diminuição da solubilidade do oxigênio na água.
Exercício resolvido da questão 8
Alternativa correta: c) refrigerante em recipiente fechado.
Exercício resolvido da questão 9
Alternativa correta: c) 80.
Exercício resolvido da questão 10
Alternativa correta: b) pode apresentar um teor de F– até cerca de 8 vezes maior que o VMP.
Gostou dos nossos exercícios de Solubilidade? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, mensalidade e muito mais.
Experimente agora!





