O pH é uma escala que mede o grau de acidez, alcalinidade ou neutralidade de alguma solução, sendo determinada pela concentração de hidrogênio nas substâncias. O pOH tem a mesma finalidade, mas possui algumas diferenças. Leia nosso resumo e treine com os 5 melhores exercícios sobre pH e pOH com gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- O que é a escala pH?
- O que é a escala pOH?
- Qual a diferença entre pH e pOH?
- Exercícios sobre pH e pOH
- Gabarito das questões sobre pH e pOH
- Nós conectamos você à faculdade!
Quando você terminar os exercícios sobre pH e pOH, coloque em prática todo seu conhecimento com o Simulado ENEM do Beduka!
O que é a escala pH?
A escala do pH varia em uma faixa que vai de 0 a 14.
Essa pontuação é dividida em três partes: ácido, neutro e básico.
- A substância possui um pH MENOR do que 7? Então ela é ácida.
- A substância possui um pH IGUAL a 7? Então ela é neutra.
- A substância possui um pH MAIOR do que 7? Então ela é básica.
Sabendo minimamente isso já será possível acertar vários exercícios sobre pH.
Como determinar o pH?
O pH pode ser determinado de duas principais formas:
- Forma direta: utiliza-se uma ferramenta de laboratório chamada peagâmetro
- Forma indireta: utiliza-se uma fita indicadora de pH
A matemática do pH
A escala de pH trabalha pela concentração de H+ e de OH-. Ou seja:
- A concentração de H+ é MAIOR que a de OH-? Então a substância é ácida.
- A concentração de H+ é IGUAL a de OH-? Então a substância é neutra.
- A concentração de H+ é MENOR do que a de OH-? Então a substância é básica.
Esta é a equação que nos dá o valor de pH:
pH = -log[H+]
Esqueceu como se calcula usando logaritmo (log)? Não tem problema, aqui temos tudo que você precisa para compreender logaritmo.
O que é a escala pOH?
Uma dica que facilita todo o aprendizado, é perceber que a escala de pOH funciona como uma espécie de “escala de pH ao contrário”. Sabendo disso, você perceberá que é muito simples calculá-lo.
A escala do pOH também varia em uma faixa que vai de 0 a 14.
Essa pontuação é dividida em três partes: ácido, neutro e básico.
- A substância possui um pOH MENOR do que 7? Então ela é básica.
- A substância possui um pOH IGUAL a 7? Então ela é neutra.
- A substância possui um pOH MAIOR do que 7? Então ela é ácida.
Agora se você se deparar com pOH nos exercícios de PH, não terá dificuldade e não fará confusão.
A matemática do pOH
A escala de pOH também trabalha pela concentração de H+ e de OH-. Ou seja:
- A concentração de H+ é MAIOR que a de OH-? Então a substância é ácida.
- A concentração de H+ é IGUAL a de OH-? Então a substância é neutra.
- A concentração de H+ é MENOR do que a de OH-? Então a substância é básica.
Sendo a equação que nos dá o valor de pOH:
pOH = -log[OH–]
Qual a diferença entre pH e pOH?
Essas escalas são muito importantes tanto para cientistas que trabalham em laboratório e necessitam dessa informação, quanto para pessoas comuns que se deparam com alimentos ou outros produtos básicos, ácidos ou neutros que entram em contato com nosso organismo.
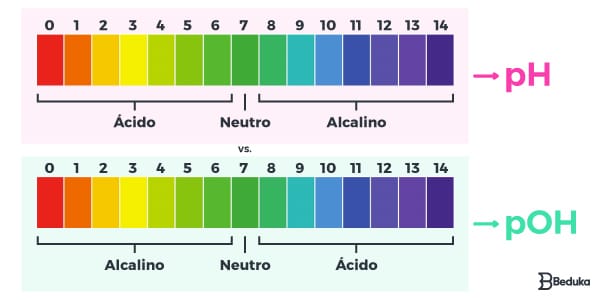
Os vestibulares preferem focar na parte que diz respeito à escala e determinação, principalmente do pH. Em alguns casos, é possível que o vestibular cobre a relação entre as pH e pOH, por isso é preciso saber comparar as suas escalas.
Existe uma relação matemática muito simples entre pH e pOH dadas pela seguinte equação:
PH + POH = 14
Agora que você entendeu tudo sobre o que são as escalas de pH e pOH, responda os melhores exercícios sobre pH e pOH!
Exercícios sobre pH e pOH
Questão 1 – (UFV)
O equilíbrio de ionização da água pura é dado pela equação abaixo, cuja constante do produto iônico (Kw) é 2,5×10–14, a 37 ºC.
H2O ↔ H+ + OH–
Assinale a alternativa que indica CORRETAMENTE o valor de pH da água pura nessa temperatura: (Dado: log101,58 = 0,2)
a) 7,0.
b) 6,8.
c) 7,8.
d) 9,0.
e) 5,0.
Questão 2 – (ESCS-DF)
A tabela a seguir fornece a concentração hidrogeniônica ou hidroxiliônica a 25°C, em mol/L, de alguns produtos:
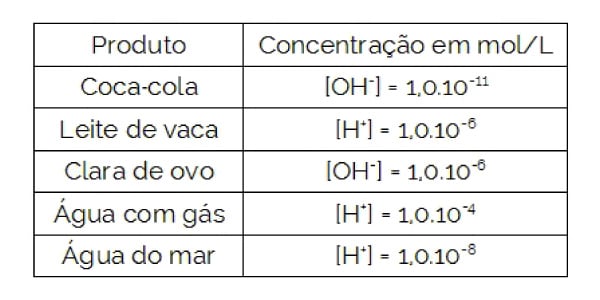
Com base nesses dados, NÃO é correto afirmar que:
a) a água do mar tem pOH = 6.
b) a água com gás tem pH maior do que a Coca-Cola e menor do que o leite de vaca.
c) a água do mar tem pH básico.
d) a clara de ovo é mais básica que o leite de vaca.
e) a clara de ovo tem maior pH do que a água do mar.
Questão 3 – (UnB)
Os sistemas químicos baseiam-se em algumas características. Os sistemas ácidos caracterizam-se pela liberação de íon hidrônio,H3O1+(aq). Os sistemas básicos baseiam-se na liberação de íon hidroxila, OH –(aq). A tabela a seguir mostra a característica de alguns sistemas.
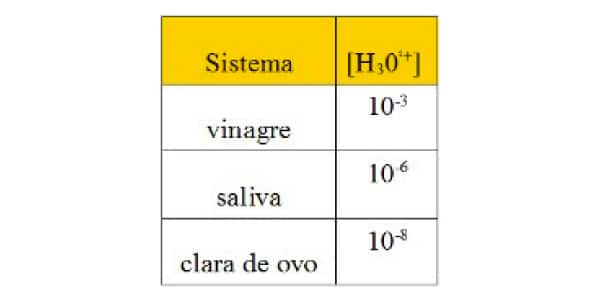
Tabela em exercício de pH
Considerando os sistemas citados, 100% ionizados, julgue os itens abaixo.
- I. Todos os sistemas são formados por substâncias ácidas.
- II. O pOH da saliva é igual a 6.
- III. O vinagre é mais ácido que a clara de ovo.
- IV. O pH do vinagre é igual a 3.
- V. Acrescentando uma gota de vinagre a uma gota de saliva, a solução se tornará neutra.
Quais dos itens são FALSOS?
a) I, III e IV.
b) II, III, IV e V.
c) I e III.
d) III e IV.
e) I, II e V.
- Estamos apenas no começo dos exercícios sobre pH e pOH. Concentre-se e dê o seu melhor!
Questão 4 – (UFPE)
A concentração hidrogeniônica do suco de limão puro é 10-3 mol/L. Qual o pH de um refresco preparado com 20 mL de suco de limão e água suficiente para completar 200 mL?
a) 2,5.
b) 3,0.
c) 3,5.
d) 4,0.
e) 4,5.
Questão 5 – (FUVEST)
A autoionização da água é uma reação endotérmica. Um estudante mediu o pH da água recém destilada, isenta de CO2 e a 50 °C, encontrando o valor 6,6. Desconfiado de que o aparelho de medida estivesse com defeito, pois esperava o valor 7,0, consultou um colega que fez as seguintes afirmações:
(I) seu valor (6,6) pode estar correto, pois 7,0 é o pH da água pura, porém a 25 °C;
(II) a aplicação do princípio de Le Chatelier ao equilíbrio da ionização da água justifica que, com o aumento da temperatura, aumente a concentração de H+ ;
(III) na água, o pH é tanto menor quanto maior a concentração de H+ .
Está CORRETO o que se afirma
a) somente em I.
b) somente em II.
c) somente em III.
d) somente em I e II.
e) em I, II e III.
- Muito bem! Você chegou na metade dos exercícios sobre pH e pOH.
Questão 6 – (ENEM)
Diversos produtos naturais podem ser obtidos de plantas por processo de extração. O lapachol é da classe das naftoquinonas. Sua estrutura apresenta uma hidroxila enólica (pKa = 6,0) que permite que este composto seja isolado da serragem dos ipês por extração com solução adequada, seguida de filtração simples. Considere que pKa = -log Ka, em que Ka é a constante ácida da reação de ionização do lapachol.
Qual solução deve ser usada para extração do lapachol da serragem do ipê com maior eficiência?
a) Solução de Na2CO3 para formar um sal de lapachol.
b) Solução-tampão ácido acético/acetato de sódio (pH = 4,5).
c) Solução de NaCI a fim de aumentar a força iônica do meio.
d) Solução de Na2SO4 para formar um par iônico com lapachol.
e) Solução de HCI a fim de extraí-lo por meio de reação ácido-base.
Questão 7 – (ENEM)
Visando minimizar impactos ambientais, a legislação brasileira determina que resíduos químicos lançados diretamente no corpo receptor tenham pH entre 5,0 e 9,0. Um resíduo líquido aquoso gerado em um processo industrial tem concentração de íons hidroxila igual a 1,0 X 10-10 mol/L. Para atender a legislação, um químico separou as seguintes substâncias, disponibilizadas no almoxarifado da empresa: CH3COOH, Na2SO4, CH3OH, K2CO3 e NH4Cl.
Para que o resíduo possa ser lançado diretamente no corpo receptor, qual substância poderia ser empregada no ajuste do pH?
a) H₃COOH
b) Na₂SO₄
c) CH₃OH
d) K₂CO₃
e) NH₄Cl
Questão 8 – (UNESP)
A 25°C, o pOH de uma solução de ácido clorídrico, de concentração 0,10 mol/L, admitindo-se ionização total do ácido, é:
Dados (a 25 °C): (H+) (OH-) = 1,0 · 10-14; pOH = -log (OH-)
a) 10-13
b) 10-1
c) 1
d) 7
e) 13
- Calma, a lista de exercícios sobre pH e pOH está chegando ao fim. Vamos com tudo para os dois últimos exercícios!
Questão 9 – (UNESP)
O leite de magnésia, constituído por uma suspensão aquosa de Mg(OH)2, apresenta pH igual a 10. Isso significa que:
a) O leite de magnésia tem propriedades ácidas.
b) A concentração de íons OH– é igual a 10–10 mol/L.
c) A concentração de íons H3O + é igual a 10–10 mol/L.
d) A concentração de íons H3O + é igual a 1010 mol/L.
e) A soma das concentrações dos íons H3O + e OH– é igual a 10–14 mol/L
Questão 10 – (FUVEST)
Ao tomar dois copos de água, uma pessoa diluiu seu suco gástrico (solução contendo ácido clorídrico), de pH = 1, de 50 para 500 mL. Qual será o pH da solução resultante logo após a ingestão da água?
a) 0
b) 2
c) 4
d) 6
e) 8
- Parabéns, você fez todos os exercícios sobre pH e pOH!
Gabarito das questões sobre pH e pOH
Exercício resolvido da questão 1 –
Alternativa correta: b) 6,8.
Exercício resolvido da questão 2 –
Alternativa correta: e) a clara de ovo tem maior pH do que a água do mar.
Exercício resolvido da questão 3 –
Alternativa correta: e) I, II e V.
Exercício resolvido da questão 4 –
Alternativa correta: d) 4,0.
Exercício resolvido da questão 5 –
Alternativa correta: e) em I, II e III.
Exercício resolvido da questão 6 –
Alternativa correta: a) Solução de Na2CO3 para formar um sal de lapachol.
Exercício resolvido da questão 7 –
Alternativa correta: d) K₂CO₃
Exercício resolvido da questão 8 –
Alternativa correta: e) 13
Exercício resolvido da questão 9 –
Alternativa correta: c) A concentração de íons H3O + é igual a 10–10 mol/L.
Exercício resolvido da questão 10 –
Alternativa correta: b) 2
Esperamos ter ajudado com a nossa seleção dos melhores exercícios sobre pH e pOH. Bons estudos!
Nós conectamos você à faculdade!
Nosso maior objetivo é te ver cursando a faculdade dos seus sonhos e para isso sempre trazemos as melhores soluções.
Na plataforma do Beduka Bolsas você pode encontrar uma bolsa de estudos com até 65% de desconto na mensalidade. Além de escolher entre mais de 90 cursos em uma de nossas universidades parceiras. Garanta já a sua bolsa!
Receba nossos conteúdos diários e gratuitos seguindo o Instagram e o Pinterest! Nessas redes postamos resumos sobre os principais assuntos do Enem e Vestibulares.
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.





