O que é estrutura atômica? A estrutura atômica é composta por três partículas fundamentais: prótons, nêutrons e elétrons. Saiba mais sobre cada partícula e sobre os modelos atômicos nesse artigo!
Nesse artigo iremos explicar o que é estrutura atômica, além de explicar sobre os modelos atômicos e tirar as principais dúvidas sobre o assunto. Clique no tópico de seu interesse:
- O que são os átomos?
- Quais são os principais modelos atômicos?
- O que é estrutura atômica?
- Nós conectamos você à faculdade!
Depois de ler este resumo sobre o que é estrutura atômica, teste seus conhecimentos com o Simulado Enem do Beduka. Ele é 100% gratuito e utiliza o método TRI de correção!
O que são os átomos?
Se você está se preparando para o vestibular e já começou a estudar química então você já deve saber que os átomos são a base dessa matéria.
Na verdade, eles são a base de tudo no universo já que ele é o que constitui a matéria (tudo aquilo que ocupa espaço e possui massa).
Os átomos são partículas infinitamente pequenas que constituem toda a matéria do universo. O estudo do átomo iniciou na Grécia Antiga com o filósofo Leucipo e seu discípulo Demócrito. Para eles o átomo era o menor componente de toda matéria existente. Então, era impossível que ela fosse dividido em partes menores.
- Aproveite e faça os exercícios sobre átomos!
Ao desenrolar da história, diversos cientistas e estudiosos tentaram definir o átomo quanto a sua forma, dando origem a diversas teorias sobre sua constituição física. Surgiram, então, os modelos atômicos.
Quais são os principais modelos atômicos?
Confira abaixo o resumo dos 4 principais modelos atômicos estudados.
Modelo Atômico de Dalton

Para Dalton, a teoria de Leucipo e Demócrito era muito coerente. De acordo com esse modelo, os átomos eram as menores partículas possíveis, assumiam formas esféricas e possuíam massa semelhante caso fossem correspondente ao mesmo elemento químico.
Esse modelo é conhecido como bola de bilhar e possui os seguintes princípios:
- Todas as substâncias são formadas de pequenas partículas chamadas átomos;
- Os átomos de diferentes elementos possuem diferentes propriedades, mas quando os átomos são do mesmo elemento eles são exatamente iguais;
- Os átomos não se alteram quando formam componentes químicos;
- Os átomos são permanentes e indivisíveis e não podem ser criados ou destruídos;
- As reações químicas correspondem a uma reorganização de átomos.
Modelo Atômico de Thomson

Através da descoberta do elétron (partícula que constitui o átomo e que possui carga elétrica negativa), o modelo atômico de Dalton se tornou defasado. E com os estudos de Thomson um novo modelo foi idealizado.
O modelo atômico de Thomson foi o primeiro a realizar a divisibilidade do átomo. Ao pesquisar sobre raios catódicos, o físico inglês propôs esse modelo que ficou conhecido como o modelo pudim de ameixa.
De acordo com esse modelo, o átomo era uma esfera de carga elétrica positiva incrustada com elétrons, de carga negativa, tornando-se assim eletricamente neutro.
Ele descobriu essa mínima partícula e assim estabeleceu a teoria da natureza elétrica da matéria. Concluiu que os elétrons eram constituintes de todos os tipos de matéria, pois observou que a relação carga/massa do elétron era a mesma para qualquer gás empregado em suas experiências.
Devido aos seus estudos em relação à essa partícula, Thomson se tornou “pai do elétron”.
Modelo Atômico de Rutherford

Em 1911, o físico Rutherford colocou uma folha de ouro muito fina dentro de uma câmara metálica. Seu objetivo era analisar a trajetória das partículas alfa a partir do obstáculo criado pela folha de ouro.
Nesse experimento, Rutherford observou que algumas partículas ficavam totalmente bloqueadas. Outras partículas não eram afetadas, mas a maioria ultrapassava a folha sofrendo desvios.
Segundo o físico, esse comportamento podia ser explicados graças às forças de repulsão elétrica entre essas partículas.
Devido às suas observações, ele afirmou que o átomo era nucleado e sua parte positiva se concentrava num volume extremamente pequeno, que seria o próprio núcleo.
O modelo atômico de Rutherford é também conhecido como modelo planetário, pois corresponde a uma modelo planetário em miniatura. Nesse modelo, os elétrons se movem em órbitas circulares ao redor do núcleo.
Modelo Atômico de Bohr
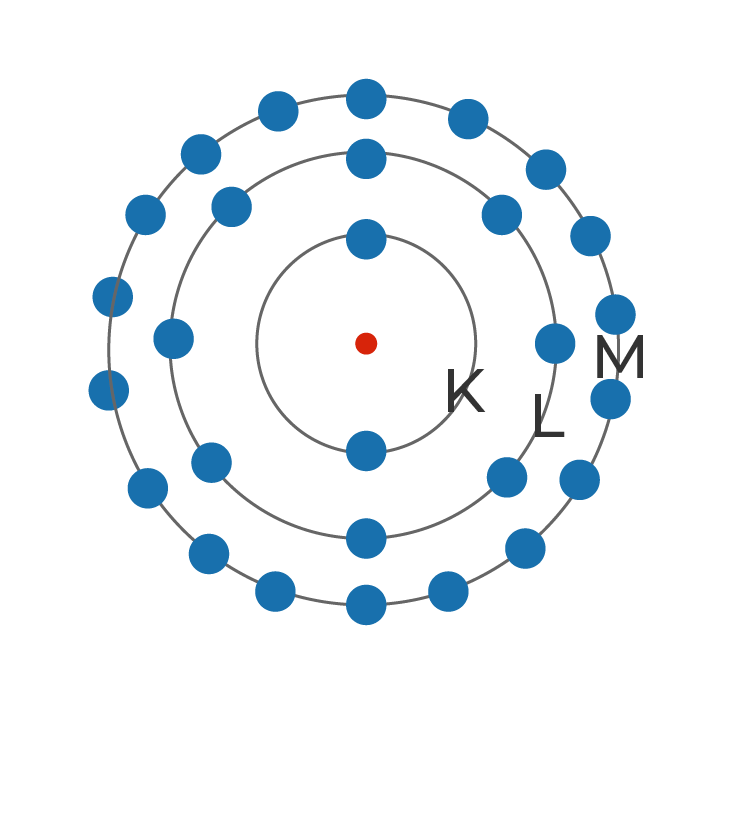
O modelo apresentado por Rutherford foi aperfeiçoado por Bohr. A teoria do físico Niels Bohr estabeleceu as seguintes concepções atômicas:
- Os elétrons que giram ao redor do núcleo não giram ao acaso, e sim fazer rotas determinadas;
- O átomo é extremamente pequeno, mesmo assim a maior parte do átomo é vazia. O diâmetro do núcleo atômico é cerca de cem mil vezes menor que o átomo todo. Os elétrons giram tão depressa que parecem tomar todo o espaço.
- Quando os elétrons saltam de uma órbita para a outra resulta luz. Bohr conseguiu prever os comprimentos de onda a partir da constituição do átomo e do salto dos elétrons de uma órbita para a outra.
O que é estrutura atômica?
É estrutura atômica é a composição de um átomo, partículas infinitamente pequenas que constituem toda a matéria do universo. São três partículas fundamentais: prótons (positivos), elétrons (negativos) e nêutrons (neutros).
- Prótons (+)
- Nêutrons (-)
- Elétrons (0)
Prótons
O próton é uma partícula fundamental na estrutura atômica. Ele possui carga positiva e, juntamente com os nêutrons, forma todos os núcleos atômicos. Exceto o núcleo atômico do hidrogênio que é formado por um único próton.
O que caracteriza um elemento é número de prótons do átomo, também conhecido como número atômico do elemento.
A massa de um átomo é a soma dos prótons e nêutrons. Como a massa do elétron é muito pequena, ela não é considerada. A massa do átomo é representada pela letra (A), o número de prótons pela letra (Z) e o número de nêutrons pela letra (N). Ou seja: A = Z + N.
Nêutrons
Os nêutrons são partículas neutras que fazem parte da estrutura atômica. Ele possui massa, mas não possui carga.
O nêutron se localiza na porção central do átomo, ou seja, no núcleo. E para se calcular a quantidade exata de nêutrons em um átomo é só fazer a subtração entre o número de massa (A) e o número atômico (Z). Ou seja: N = A – Z.
Elétrons
O elétron é uma partícula subatômica que circunda o núcleo atômico, sendo responsável pela criação de campos magnéticos eletrônicos.
Um próton na presença de outro próton se repele, o mesmo ocorre com os elétrons, mas entre um próton e um elétron existe uma força de atração. Dessa maneira atribui-se ao próton e ao elétron uma propriedade física denominada carga elétrica. Enquanto a carga do próton é positiva, a do elétron é negativa.
Os elétrons dos átomos giram em órbitas específicas e de níveis energéticos bem definidos. Sempre que um elétron muda de órbita, um pacote de energia seria emitido ou absorvido.
Semelhança entre os átomos
Os isótopos, isóbaros e isótonos são classificações dos átomos dos elementos químicos presentes na tabela periódica, de acordo com a quantidade de prótons, elétrons e nêutrons presentes em cada um deles.
Átomos Isótopos
São átomos que possuem mesmo número atômico (Z), mas números de massa (A) diferentes. Ou seja, o número de prótons é igual, mas o número de nêutrons é diferente. Podemos observar que como possuem o mesmo número atômico são átomos de um mesmo elemento químico.
Átomos Isóbaros
São átomos que possuem o mesmo número de massa (A) e diferentes números atômicos (Z).
Átomos Isótonos
São átomos que possuem o mesmo número de nêutrons (N) e diferentes números atômicos (Z) e de massa (A).
Esperamos ter ajudado você a entender o que é estrutura atômica. No mais, não deixe de conferir a oportunidade incrível que espera por você a seguir!
Nós conectamos você à faculdade!
Já pensou fazer faculdade em uma das melhores universidades do Brasil e ainda economizar o seu dinheiro?
Nós conectamos você à faculdade com o Beduka Bolsas!
Nesse programa, você pode adquirir uma bolsa de estudos de até 65% de desconto na mensalidade, a qualquer momento, sem precisar de Enem ou vestibular.
É isso mesmo! Essa é a sua chance de fazer o curso dos seus sonhos pagando pouco. São mais de 90 opções de cursos para você escolher, em 8 universidades parceiras de excelentíssimo nível!
Siga o Beduka no Instagram e no Tiktok e receba conteúdos gratuitos sobre o Enem e outros vestibulares diariamente.
Obrigada por ler até o final!





