Qual é a definição de solubilidade? A solubilidade é uma propriedade físico-química da matéria, é a capacidade que um material (soluto) ser dissolvido por outro (solvente). Logo, a definição é: propriedade de uma substância dissolver-se em outra.
No caderno de Ciências da Natureza e suas tecnologias do ENEM, as questões de Química sempre são motivos de preocupação dos estudantes. Dentro dessa matéria, entender o que é solubilidade é essencial para responder questões que surgem sobre essa matéria.
Não deixe de conferir nossos exercícios sobre Solubilidade.
Nesse artigo vamos falar sobre:
- O que é Solubilidade;
- Coeficiente de Solubilidade;
- Saturação, Insaturação e Supersaturação.
Conceitos de solubilidade iniciais
- Soluções: São as misturas resultantes da união de duas ou mais substâncias diferentes, e que se apresentam em uma única fase no seu aspecto visual, ou seja, de forma homogênea. Por se tratar de misturas homogêneas, as soluções são formadas pela associação de pelo menos um material capaz de ser dissolvido por outro;
- Soluto: O soluto é uma substância que está dispersa em um meio, ou seja, é a substância que será dissolvida em um solvente, a fim de formar uma solução homogênea qualquer;
- Solvente: O solvente é a substância onde o soluto é disperso, ou seja, é a parte que se apresenta em maior quantidade em uma solução, e onde o soluto é dissolvido. O solvente mais utilizado é a água, que também é conhecido como solvente universal.
O que é Solubilidade?
Solubilidade é a propriedade física das substâncias de se dissolverem, ou não, em um determinado líquido. A dissolução química é o processo de dispersão do soluto em um solvente, dando a origem a uma solução ou mistura homogênea.

Os solutos podem ser classificados em:
- Solúveis: aqueles que se dissolvem no solvente. O cloreto de sódio (soluto), por exemplo, é solúvel na água (solvente);
- Pouco solúveis: aqueles que apresentam dificuldade de se dissolver no solvente. É o caso do hidróxido de cálcio [Ca(OH)2] (soluto) em água;
- Insolúveis: aqueles que não se dissolvem no solvente. A areia (soluto), por exemplo, é insolúvel na água.
Um princípio da solubilidade é que um soluto polar tende a se dissolver em um solvente polar. Isso também acontece para substâncias apolares.
Fatores que Influenciam a Solubilidade
Mesmo quando o soluto é solúvel no solvente, existem alguns fatores que podem influenciar a capacidade de dissolução do soluto. São eles:
Relação entre a quantidade de soluto e de solvente
O solvente sempre possui um limite de soluto que consegue dissolver. Se aumentarmos a quantidade de solvente, mantendo a quantidade de soluto, o solvente tende a dissolver todo o soluto utilizado.
Temperatura
A temperatura é o único fator físico capaz de modificar a solubilidade de um solvente com relação a um determinado soluto. E essa modificação depende da natureza do soluto, que pode ser:
Soluto Endotérmico
É o soluto que consegue se dissolver uma maior massa, desde que o solvente esteja em uma temperatura maior que a temperatura ambiente. Ou seja, quanto mais quente estiver o solvente, mais soluto será dissolvido.
Exemplo: Pode-se dissolver uma maior quantidade de café em pó quando a água está quente.
Soluto Exotérmico
É o soluto que consegue se dissolver uma maior massa, desde que o solvente esteja em uma temperatura menor que a temperatura ambiente. Ou seja, quanto mais frio estiver o solvente, mais soluto será dissolvido.
Exemplo: É possível dissolver uma maior quantidade de gás carbônico quando o refrigerante está gelado.
Coeficiente de Solubilidade
O coeficiente de solubilidade determina a capacidade máxima do soluto que se dissolve em uma determinada quantidade de solvente, de acordo as condições de temperatura. Pode-se dizer que coeficiente de solubilidade é a quantidade de soluto necessária para saturar uma quantidade padrão de solvente a uma determinada condição.
Tomando um copo de água com sal (NaCl) como exemplo, a princípio o sal desaparece na água. Entretanto, à medida que se adiciona mais sal, em algum momento ele começará a se acumular no fundo do copo.
Isso ocorre pois o solvente, a água, atingiu o seu limite de solubilidade e a quantidade máxima de concentração, e esse acontecimento também pode ser denominado ponto de saturação. O soluto que resta no fundo do recipiente e que não se dissolve é chamado de corpo de fundo ou precipitado.
Ao misturar um soluto com um solvente, a solução pode apresentar três diferentes tipos:
- Saturada: quando atinge o limite da saturação, ou seja, o soluto está na quantidade exata do coeficiente de solubilidade;
- Insaturada: quando a quantidade de soluto é inferior ao coeficiente de solubilidade;
- Supersaturada: quando a quantidade de soluto ultrapassa o coeficiente de solubilidade.
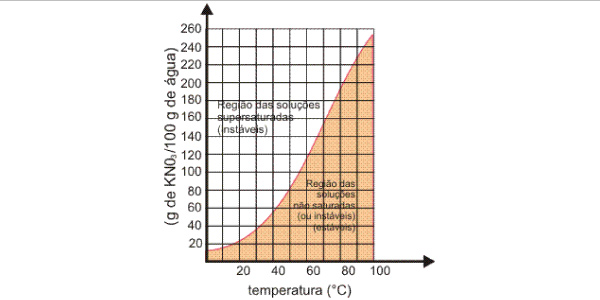
Curva de Solubilidade
A solubilidade varia de acordo com o tipo de soluto e também com o tipo de solvente, assim, o coeficiente de solubilidade varia com a temperatura, podendo aumentar ou diminuir com a elevação de temperatura, dependendo do soluto em questão.
A variação do coeficiente de solubilidade em função da temperatura é representado em um gráfico que chamamos de curva de solubilidade.
Unidades de Concentração
As diferentes relações entre a quantidade de soluto, de solvente e de solução são denominadas genericamente de concentrações.
Concentração Comum
Também chamada concentração em g/L (grama por litro), a concentração relaciona a massa do soluto em gramas com o volume da solução em litros.
C = m/V
Concentração em Quantidade de Matéria (Cn)
Relaciona a quantidade de soluto (mols) com o volume da solução, em litros, e sua unidade é mol/L:
Cn = n/V
Título (T)
Relaciona a massa de soluto (m) com a massa da solução (M), ou o volume do soluto (v) com o volume da solução (V).
T = m/M
T = v/V
O título não tem unidade, pois é uma divisão de dois valores de massa ou volume.
Densidade da Solução (d)
Relaciona a massa (m) e o volume da solução (V):
d = m/V
Geralmente as unidades usadas são g/mL ou g/cm3.
A densidade não pode ser confundida com concentração comum, pois as duas relacionam massa com volume. Na concentração comum se relaciona a massa de soluto com o volume da solução e, na densidade, a massa de solução com o volume da solução.
Além de aprender o que é solubilidade, você pode testar seus conhecimentos de outras matérias respondendo algumas questões que caíram em edições antigas do Exame em nosso simulado gratuito.
Gostou de aprender o que é solubilidade? Queremos te ajudar também a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!