Na termodinâmica é que estudamos a Lei de Hess, que foi desenvolvida para falar sobre a energia. Ela diz que a energia não é criada e nem destruída, portanto, pode ser transformada de uma forma para a outra. Leia nosso resumo e treine com os melhores exercícios de Lei de Hess com gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- O que é a Lei de Hess?
- Qual é a fórmula da Lei de Hess?
- Lista de exercícios sobre Lei de Hess!
- Respostas dos exercícios de Lei de Hess.
Quando você terminar as questões sobre Lei de Hess, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que é Lei de Hess?
O químico Germain Henry Hess (1802-1850), foi essencial para o desenvolvimento e progresso na área de termoquímica.
Como por exemplo a Lei de Hess, que é uma lei experimental responsável por estabelecer que o valor da variação de entalpia, depende do estado final e inicial de determinadas reações.
Lei de Hess é uma lei desenvolvida para calcular a variação da entalpia, sendo a quantidade de energia disponível nas substâncias após passarem por processos e reações químicas.
A termoquímica é fundamentada pela Lei de Hess, sendo importante para o desenvolvimento dos estudos. A lei de Hess foi estudada e experimentada pelo médico e químico Germain Henry Hess, sendo descrita como:
“A variação de entalpia (ΔH) em uma reação química depende apenas dos estados inicial e final da reação, independente do número de reações.”
- São mais de 200 resumos no Instagram do Beduka!
Qual é a fórmula da Lei de Hess?
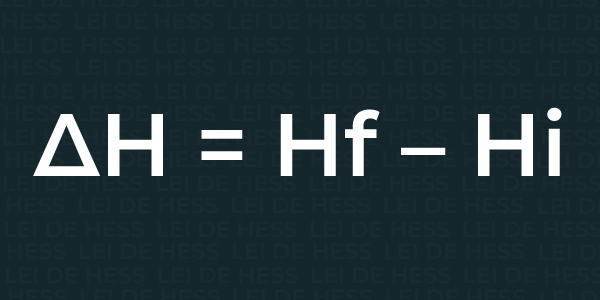
Podemos calcular a variação da entapia a partir da subtração da entalpia inicial (que é antes da reação) com a entalpia final (depois da reação). É como mostra a fórmula acima.
Também é possível calcular a Lei de Hess por meio da soma das entalpias de cada reação intermediária, independentemente do tipo e quantidade das reações presentes. Veja a fórmula:
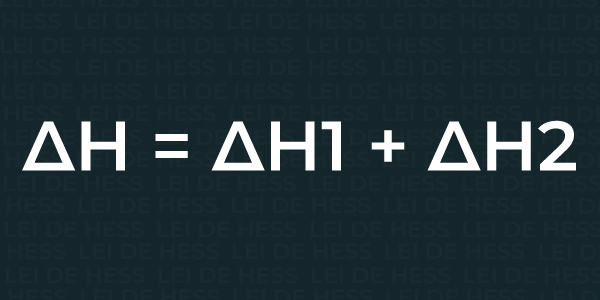
Nesse cálculo os únicos valores importantes são o inicial e o final, sendo o valor da energia intermediária irrelevante para o resultado final da sua variação.
Além disso, a Lei de Hess pode ser calculada a partir de uma equação matemática, basta inverter a reação química.
No caso acima, o sinal ΔH deve ser trocado, depois, realizar toda a multiplicação da equação. Por fim, é necessário realizar a divisão da equação.
Agora é a sua vez de testar os conhecimentos sobre o assunto! Faça as questões sobre Lei de Hess abaixo e confira as respostas no gabarito!
Exercícios de Lei de Hess
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (FGV-SP)
Em um conversor catalítico, usado em veículos automotores em seu cano de escape para redução da poluição atmosférica, ocorrem várias reações químicas, sendo que uma das mais importantes é:
1 CO(g) + ½ O2(g) → 1 CO2(g)
Sabendo-se que as entalpias das reações citadas abaixo são:
C(grafita) + ½ O2(g) → CO(g) ∆H1 = -26,4 kcal
C(grafita) + O2(g) → CO2(g) ∆H2 = -94,1 kcal
Pode-se afirmar que a reação inicial é:
a) exotérmica e absorve 67,7 kcal/mol.
b) exotérmica e libera 120,5 kcal/mol.
c) exotérmica e libera 67,7 kcal/mol.
d) endotérmica e absorve 120,5 kcal/mol.
e) endotérmica e absorve 67,7 kcal/mol.
Questão 2 – (Cesgranrio-RJ)
O elemento químico tungstênio, W, é muito utilizado em filamentos de lâmpadas incandescentes comuns. Quando ligado a elementos como carbono ou boro, forma substâncias quimicamente inertes e muito duras. O carbeto de tungstênio, WC(s), muito utilizado em esmeris, lixas para metais etc., pode ser obtido pela reação:
1 C(grafite) + 1 W(s) → 1 WC(s)
A partir das reações a seguir, calcule o ∆H de formação para o WC(s). Dados:
1 W(s) + 3/2 O2(g) → 1 WO3(s) ∆HCOMBUSTÃO = -840 kJ/mol
1 C(grafite) + 1 O2(g) → 1 CO2(g) ∆HCOMBUSTÃO = -394 kJ/mol
1 WC(s) + 5/2 O2(g) → 1WO3(s) + 1 CO2(g) ∆HCOMBUSTÃO =-1196 kJ/mol
a) – 19 kJ/mol.
b) + 38 kJ/mol.
c) – 38 kJ/mol.
d) + 2 430 kJ/mol.
e) – 2 430 kJ/mol.
Questão 3 – (Unificado-RJ)
O gás hilariane (N2O) tem características anestésicas e age sobre o sistema nervoso central, fazendo com que as pessoas riam de forma histérica. Sua obtenção é feita a partir de decomposição térmica do nitrato de amônio (NH4NO3), que se inicia a 185 °C, de acordo com a seguinte equação:
NH4NO3(s) → N2O(g) + 2H2O(g)
No entanto, o processo é exotérmico e a temperatura fornecida age como energia de ativação. Sabe-se que as formações das substâncias N2O, H2O e NH4NO3 ocorrem por meio das seguintes equações termoquímicas:
N2(g) + ½ O2(g) → N2O(g) – 19,5 kcal
H2(g) + ½ O2(g) → H2O(g) + 57,8 kcal
N2(g) + 2 H2(g) + 3/2 O2(g) → NH4NO3(s) + 87,3 kcal
A quantidade de calor liberada, em Kcal, no processo de obtenção do gás hilariante é:
a) 8,8.
b) 17,6.
c) 28,3.
d) 125,6.
e) 183,4.
- Ufa, estamos quase lá! Faça os dois últimos exercícios de Lei de Hess!
Questão 4 – (ENEM/2016)
O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
3 C2H2 (g) → C6H6 (l)
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
I. C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) ∆H°C = -310 kcal/mol
II. C6H6 (l) + 15/2 O2 (g) → 6 CO2 (g) + 3 H2O (l) ∆H°C = -780 kcal/mol
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de
a) -1.090.
b) -150.
c) -50.
d) +157.
e) +470.
Questão 5 – (UDESC-2012)
O gás metano pode ser utilizado como combustível, como mostra a equação 1:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Utilizando as equações termoquímicas abaixo, que julga necessário, e os conceitos da Lei de Hess, obtenha o valor de entalpia da equação 1.
C(s) + H2O(g) → CO(g) + H2(g) ΔH = 131,3 kj mol-1
CO(g) + ½ O2(g) → CO2(g) ΔH = 283,0 kj mol-1
H2(g) + ½ O2(g) → H2O(g) ΔH = 241,8 kj mol-1
C(s) + 2H2(g) → CH4(g) ΔH = 74,8 kj mol-1
O valor da entalpia da equação 1, em kj, é:
a) -704,6.
b) -725,4.
c) -802,3.
d) -524,8.
e) -110,5.
- Parabéns, você fez todas as questões sobre a Lei de Hess!
Respostas dos Exercícios de Lei de Hess
Exercício resolvido da questão 1 –
Alternativa correta: c) exotérmica e libera 67,7 kcal/mol.
Exercício resolvido da questão 2 –
Alternativa correta: c) – 38 kJ/mol.
Exercício resolvido da questão 3 –
Alternativa correta: a) 8,8.
Exercício resolvido da questão 4 –
Alternativa correta: b) -150.
Exercício resolvido da questão 5 –
Alternativa correta: c) -802,3.
Gostou dos nossos exercícios de Lei de Hess? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, mensalidade e muito mais.
Experimente agora!








8 Comentários
Na questão 5, os valores corretos seriam:
C(s) + H2O(g) → CO(g) + H2(g) ΔH = 131,3 kj mol-1
CO(g) + ½ O2(g) → CO2(g) ΔH = -283,0 kj mol-1
H2(g) + ½ O2(g) → H2O(g) ΔH = -241,8 kj mol-1
C(s) + 2H2(g) → CH4(g) ΔH = -74,8 kj mol-1
Luís, por favor, refaça suas contas. Os valores que encontrou estão equivocados. Pode ver um de nossos textos a respeito do assunto para garantir que está fazendo corretamente.
Muito boa essas atividades , fez com que eu treinasse bem o assunto de lei de hess, muito obrigada.
Olá, Carolina! Não precisa agradecer, ficamos muito felizes em ajudá-la.
Revise a questão 5 não consegui entender
Matheus, pegamos a questão diretamente do vestibular da universidade. Não podemos revisá-la. Mas vamos te explicar o cálculo:
Para calcular o valor de entalpia da equação, podemos utilizar a Lei de Hess e somar as entalpias das reações que envolvem as substâncias reagentes e produtos da equação, multiplicando-as pelos coeficientes estequiométricos apropriados e invertendo as equações que precisam ser revertidas. Assim, teremos:
Inverter a equação da formação do metano e multiplicá-la por 1:
C(s) + 2H2(g) → CH4(g) ΔH = +74,8 kJ/mol
Multiplicar a equação da formação do dióxido de carbono por 1:
CO(g) + ½ O2(g) → CO2(g) ΔH = -283,0 kJ/mol
Multiplicar a equação da formação da água por 2:
H2(g) + ½ O2(g) → H2O(g) ΔH = -241,8 kJ/mol
Somar as equações 1, 2 e 3, multiplicando-as pelos coeficientes estequiométricos apropriados:
C(s) + 2H2(g) + O2(g) → CO2(g) + 2H2O(g) ΔH = 74,8 kJ/mol + (-283,0 kJ/mol) + 2(-241,8 kJ/mol) = -802,3 kJ/mol
poderia melhorar mas nos cálculos ,esta precisando elaborar melhor
Oi, Luiza! Você está sugerindo que mostremos os cálculos para chegar aos resultados? Já está nos nossos planos, em breve faremos isso.