O Mol é uma unidade de medida química, usada para se referir à quantidade de substâncias. Essa grandeza costuma ser utilizada para simplificar grandes proporções, então envolve notação científica. Leia nosso resumo e treine com os melhores exercícios sobre Mol com gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
Quando você terminar os exercícios de Mol, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que é Mol?
Mol é uma unidade de medida usada para medir a quantidade de matéria microscópica, como, por exemplo, os átomos e as moléculas, que não podem ser vistos a olho nú.
O químico Wilhelm Ostwald foi o primeiro a propor o termo latim mole, que é derivado da palavra molécula, em 1896.
Porém, foi apenas no século XX, que o químico Frances Jean Baptiste Perrin fez alguns estudos e a partir deles os cientistas conseguiram determinar qual é o valor da matéria presente em um mol, que seria:
6,02.1023 entidades
Após esses estudos foi possível determinar a quantidade que existe em um mol de qualquer matéria ou componente do átomo, como por exemplo os elétrons, prótons e nêutrons. Veja a exemplificação abaixo:
1 mol de milho = 6,02.1023 grãos de milho
- São mais de 200 resumos no Instagram do Beduka!
Como utilizar o Mol?
A utilização da unidade mol é aplicada para qualquer componente da matéria ou a matéria em si, mas ela é mais utilizada na relação da quantidade de átomos, moléculas e outros componentes atômicos.
O mol aplicado em um elemento químico deve ser utilizado seguindo a seguinte expressão:
1 mol de um elemento = 6,02.1023 átomos deste elemento
Já o mol aplicado em moléculas deve ser utilizado seguindo a seguinte expressão:
1 mol de qualquer substância = 6,02.1023 moléculas
Agora é a sua vez de testar seus conhecimentos com os exercícios sobre Mol!
Exercícios sobre Mol
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (Fuvest-SP)
A tabela abaixo apresenta o mol, em gramas, de várias substâncias:
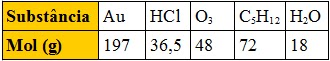
Comparando massas iguais dessas substâncias, a que apresenta maior número de moléculas é:
a) Au.
b) HCl.
c) O3.
d) C5H10.
e) H2O.
Questão 2 – (Unicid-SP)
Um químico possui uma amostra de cobre (dado: 6429Cu). A massa, em gramas, dessa amostra, sabendo-se que ela é constituída por 3,01 . 1023 átomos, é:
a) 0,32 . 1023 g.
b) 0,29 . 1023 g.
c) 1,60 . 1023 g.
d) 64,00 g.
e) 32,00 g.
Questão 3 – (Mackenzie-SP)
O volume de gás sulfídrico liberado em CNTP, quando 0,02 mol de sulfeto de sódio reage com ácido clorídrico em excesso, será:
Na2S + HCl → NaCl + H2S
a) 22,4 L.
b) 44,8 L.
c) 4,48 L.
d) 2,24 L.
e) 0,448 L.
- Muito bem! Você já está na metade dos exercícios de Mol!
Questão 4 – (FCA-PA)
O número de mols existentes em 160 g de hidróxido de sódio (NaOH) é: Dados: Na=23; O=16; H=1.
a) 2,0 mols.
b) 3,0 mols.
c) 4,0 mols.
d) 5,0 mols.
e) 6,0 mols.
Questão 5 – (UFMA)
Considere que a gasolina seja constituída apenas de 2,2,4-trimetil-pentano. Se abastecermos um veículo com 25 mol de gasolina, qual a quantidade de dióxido de carbono que será lançada na atmosfera, quando toda a gasolina for consumida? Dados: C=12u; O=16u
C8H18 + O2 → CO2 + H2O
a) 5,2 kg.
b) 6,4 kg.
c) 8,8 kg.
d) 5,4 kg.
e) 7,2 kg.
Questão 6 – (UFG GO/2001 – adaptada)
Leia o texto que se segue e responda à questão:
Grupo cria molécula com gás nobre
Os gases nobres são conhecidos pela estabilidade. Todos possuem oito elétrons na camada mais exterior (exceto o hélio, que tem apenas dois), o que faz deles os mais esnobes elementos químicos – não gostam de se misturar.
Ser um gás nobre é o sonho de todo elemento. É por essa razão que eles se unem em compostos. Os átomos comuns costumam doar ou receber elétrons de outros átomos – formando moléculas – a fim de completar seu octeto, ou seja, ficar com oito elétrons na última camada – exatamente como seus primos ricos.
Quanto menor o átomo do gás nobre, mais próximos do núcleo estão os elétrons da última camada, o que faz com que mais energia seja necessária para furtá-los.
A definição química de nobreza: Gases chamados de nobres não costumam interagir com outros elementos.
Adaptado da Folha de S. Paulo. 24 ago. 2000. p. A18.
Com base nas informações desse texto e utilizando-se dos conhecimentos da Química, pode-se afirmar que
I) quanto menor o átomo do gás nobre, maior será o primeiro potencial de ionização.
II) ao doar ou receber elétrons de outros átomos, um elemento se transforma em gás nobre.
III) a palavra interagir foi utilizada como sinônimo de reação química.
IV) os gases nobres não se misturam com outros gases.
São verdadeiras as afirmativas:
a) I e III.
b) I e II.
c) III e IV.
d) II e III.
- Parabéns, você fez todos os exercícios sobre Mol! Que tal conferir o Gabarito agora? É logo a seguir:
Gabarito dos exercícios de Mol
Exercício resolvido da questão 1 –
Alternativa correta: e) H2O.
Exercício resolvido da questão 2 –
Alternativa correta: e) 32,00 g.
Exercício resolvido da questão 3 –
Alternativa correta: e) 0,448 L.
Exercício resolvido da questão 4 –
Alternativa correta: c) 4,0 mols.
Exercício resolvido da questão 5 –
Alternativa correta: c) 8,8 kg.
Exercício resolvido da questão 6 –
Alternativa correta: a) I e III.
Gostou dos nossos exercícios sobre Mol? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, mensalidade e muito mais.
Experimente agora!








2 Comentários
alguma alma boa consegue me explicar a 2?
Matheus, a massa molar do cobre é 64 g/mol. Isso significa que 1 mol de átomos de cobre tem uma massa de 64 g.
Como sabemos o número de átomos na amostra (3,01 . 10^23), podemos calcular a quantidade de matéria (n) em mol usando a constante de Avogadro:
n = N / N_A
n = 3,01 . 10^23 / 6,02 . 10^23
n = 0,5 mol
Agora, podemos usar a massa molar para calcular a massa (m) da amostra:
m = n x MM
m = 0,5 x 64
m = 32 g
Portanto, a massa da amostra de cobre é de aproximadamente 32 gramas, letra e).