As grandezas químicas são agrupamentos de categorias (átomos, elementos, mol, …) para termos referência na hora de realizar cálculos, visto que a Química é uma ciência exata. Assim, há unidades de medida e relações de proporção entre essas grandezas: massa atômica, massa molecular, número de Avogadro, mol e massa molar.
Neste artigo sobre o que são grandezas químicas, você encontrará:
- O que é uma grandeza química?
- Quais são as grandezas químicas?
- Massa atômica, massa molecular, número de avogadro, mol e massa molar
- Estudando para as provas? Conheça nosso Simulado gratuito, que pode ser personalizado com as matérias que você mais precisa!
O que é uma grandeza química?
Grandezas são termos que utilizamos para identificar a categoria daquela quantidade, sempre em relação às coisas que podem ser expressas em números. Exemplo, a distância pode ser expressa em número e sua grandeza é representada por metro ou derivados (m, km, cm, …).
Na Química algo semelhante ocorre, pois ela é uma ciência exata que estuda as transformações da matéria e suas propriedades, em seus diferentes níveis de agrupamento. Após as partes teóricas, chegamos aos cálculos que requerem grandezas para identificar sobre o que falamos.
Algumas áreas da química que utilizam cálculos e grandezas são: eletroquímica, estequiometria e termoquímica!
Quais são as grandezas químicas?
Em cada uma das áreas da química e de acordo com o seu contexto e profundidade de análise, os cientistas utilizam grandezas e unidades de medida específicas.
Nesse artigo, vamos conhecer algumas das grandezas químicas mais básicas para você iniciar bem: massa atômica, massa molecular, número de Avogadro, mol e massa molar.
Quem definiu essas coisas foi a União Internacional de Química Pura e Aplicada (IUPAC), um órgão internacional que regulariza toda a química no mundo para que os cientistas de diversos países consigam encontrar uma mesma “linguagem” durante os experimentos.
O que é Massa Atômica (MA)?
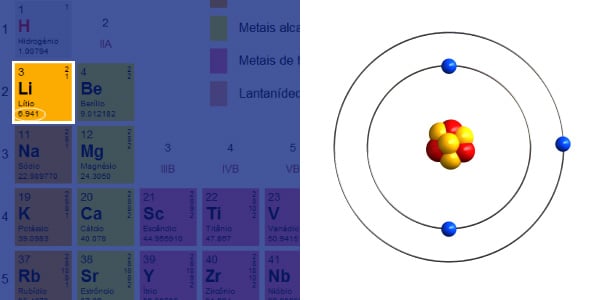
Massa é quantidade de matéria que há em um corpo, como nos seres humanos que medimos em “Kg”. Porém, o caso dos átomos é um pouquinho diferente.
Toda a matéria que conhecemos é formada por compostos, e estes são formados por átomos de cada elemento. Porém, a massa de um átomo é muito pequena para se expressar, mesmo em miligramas.
- Portanto, a unidade da massa atômica é (u). Para entender de onde ele surgiu, precisamos fazer outra analogia:
Você já sabe que, no Brasil, o termômetro aponta graus Celsius e essa escala de temperatura baseou-se na água (0° fusão e 100° ebulição). Assim, podemos ter noção da temperatura de outros elementos se compararmos sempre com esse ponto de referência.
Da mesma forma, os químicos tomaram como referência o elemento Carbono (C) para medir as outras massas atômicas.
- No caso, o carbono utilizado como referência foi o C12, de massa 12. Por esse motivo, 1u de qualquer elemento = 1/12u do C12.
- Na tabela periódica, a massa atômica é um número logo abaixo do símbolo do elemento.
Porém, alguns elementos como o Carbono, Lítio, Sódio, podem ser encontrados na natureza com variações de massas diferentes, recebendo o nome de isótopos.
Cada elemento tem uma quantidade de isótopos, portanto, se queremos calcular a massa atômica geral de um elemento, precisamos fazer a média ponderada dos isótopos.
Exemplo
O Lítio (Li) encontra-se na natureza na forma de dois isótopos: 6Li e 7Li. Eles estão presentes na proporção de 7,5 % e 92,5 % respectivamente. Então a massa atômica é calculada pela média ponderada:
(92,5 x 7 + 7,5 x 6) / (92,5 + 7,5) = 6,94 u.
O que é Massa Molecular (MM)?
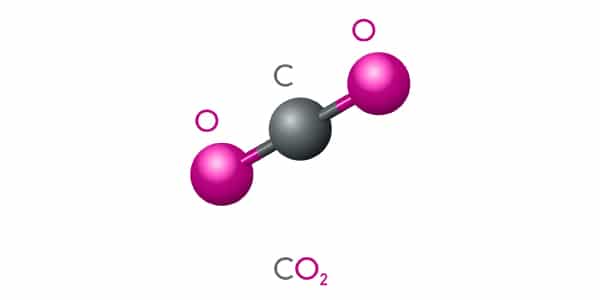
A massa molecular, como o próprio nome indica, é a massa de uma molécula. Como as moléculas são formadas por átomos, essa grandeza será dada pela soma das massas atômicas dos átomos que compõe a molécula.
Exemplo
Qual a massa molecular do gás carbônico (CO2)?
Olhando na tabela periódica, sabemos que massa atômica do C = 12u e massa atômica do O = 16u. O carbono aparece 1x na molécula e o oxigênio aparece 2x. Então:
1 x 12 + 2 x 16 = 44 u
O que é Mol?

Mol é uma grandeza que agrupa tantos números de entidades (átomos, moléculas, elétrons, etc.) quanto são os átomos contidos em 0,012 kg de C12. Aqui, novamente temos o C12 como padrão, o que já foi explicado no item de Massa Atômica.
Fazendo experimentos, concluiu-se que essa quantidade de amostra do C12 contém 6,02 x 10^23 átomos.
- Logo, 1 mol significa o agrupamento de 6,02 x 10^23 partículas quaisquer.
Exemplo
1 mol de morangos contém 6,02 x 10^23 morangos.
1 mol de átomos contém 6,02 x 10^23 átomos.
1 mol de moléculas contém 6,02 x 10^23 moléculas.
Viu? Não muda, um mol é sempre um mol, a mesma quantidade.
Massa molar (M)
Massa molar é apenas a massa molecular expressa em gramas (numericamente iguais), sendo quantos gramas 1 mol contém.
Exemplo
Gás carbônico (CO2):
Massa molecular = 44 u (somas das massas atômicas).
Se 1 mol = 44g, então massa molar será 44 g/mol.
Por meio dessa equivalência, podemos calcular o número de mols presentes em uma amostra onde a massa e a quantidade de matéria são proporcionais:
- n = m/M
Sendo
- n = número de mols
- m = número de massa em gramas
- M = massa molar da substância em g/mol
Exemplo
Quantos mols de moléculas há em 88g de dióxido de carbono (CO2)? (C = 12 u ; O = 16 u)
A massa atômica da molécula, MA CO2 = 12 + (16×2) = 44 u
A massa molar da molécula, M CO2 = 44 g/mol
Substituindo na relação:
n = 88/44
n = 2 mols.
Número de Avogadro (6,02 x 10^23)
O Número de Avogadro é uma das constantes que devemos lidar ao longo dos estudos. Constantes são apenas valores fixos para usarmos em uma determinada situação.
Já sabemos que o número pi (π) = 3,14 (aproximadamente) e o usamos na geometria. Da mesma forma, na física, sabemos que g = 10 (aproximadamente) quando falamos de gravidade na Terra. Na Química, a Constante de Avogadro = 6,02 x 10^23.
Ou seja, de 6,02 x 10^23 u (átomos) corresponde a 1 mol e também a 1 grama, mas somente se estivermos falando de um mol de átomos de hidrogênio, para os demais átomos essa correspondência tem relação à comparação com o carbono-12.
- Portanto, o Número de Avogadro indica que todo 1 mol de substância ou elemento expresso em gramas terá 6,02 x 10^23 partículas (átomos, moléculas ou íons, dependendo do contexto).
Exemplo
6,02 x 10^23 é a quantidade de átomos em 1 mol do elemento enxofre (S) de massa atômica = 32 u e massa molar = 32g.
6,02 x 10^23 é a quantidade de átomos em 1 mol do elemento alumínio (Al) de massa atômica = 27 u e massa molar = 27g.
- Como é uma constante, o número de átomos será o mesmo para elementos diferentes e, portanto, com massas atômicas/molares diferentes.
Para quê então utilizar isso? Para calcularmos o número de átomos dentro de amostras diferentes de um mesmo elemento.
Exemplo
Quantos átomos de ferro há em uma amostra contendo 3 mol desse elemento?
Se em 1 mol de ferro temos 6,02 x 1023 átomos de ferro, em 3 mol de ferro da amostra teríamos 18,06 x 1023 átomos de ferro, aproximadamente. Bastou usar uma regra de três simples.
Gostou do nosso artigo sobre o que são grandezas químicas? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





