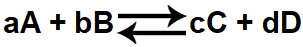
Equilíbrio Químico é o estado que ocorre dentro de uma reação química onde a concentração dos reagentes e produtos permanece constante, e a velocidade das reações permanece a mesma
No caderno de Ciências da Natureza e suas tecnologias do ENEM, as questões de Química sempre são motivo de preocupação dos estudantes. Dentro dessa matéria, entender o que é Equilíbrio Químico é essencial para responder questões que surgem sobre o tema.
Não deixe de conferir o artigo completo sobre Isomeria.
Nesse artigo vamos falar sobre:
- O que é Equilíbrio Químico;
- Constante de equilíbrio;
- Gráfico de Equilíbrio Químico.
Teste os seus conhecimentos com os nossos Exercícios sobre Equilíbrio Químico .
O que é Equilíbrio Químico?
Em uma reação química, temos reagentes e produtos. Os reagentes são as moléculas iniciais que reagem e se transformam em produtos. Essa reação química pode ocorrer de forma direta, onde os reagentes se transformam em produtos, mas também pode ocorrer de forma inversa, onde os produtos se transformam em reagentes.
Equilíbrio químico acontece quando a velocidade das duas reações, direta e inversa, permanecem as mesmas, fazendo com que o valor da concentração de produtos e reagentes sempre se mantenham constantes.

A e B são os reagentes
C e D são os produtos
V1 = Velocidade da reação direta
V2 = Velocidade da Reação inversa
Quando o equilíbrio químico é atingido, os valores de V1 e V2 são os mesmos, existindo no sistema reagentes e produtos ao mesmo tempo. As reações não param de acontecer em momento algum, somente suas velocidades são igualadas.
O que é Equilíbrio Químico Homogêneo e Heterogêneo
É chamado de equilíbrio químico homogêneo o sistema fechado, onde reagentes e produtos estão no mesmo estado físico, o que ocorre geralmente nos estados líquidos ou gasosos. Por exemplo, quando reagentes líquidos reagem formando um produto também líquido.
Já o equilíbrio químico heterogêneo acontece quando reagentes e produtos estão em estados físicos diferentes, por exemplo, quando reagentes gasosos forma produtos líquidos.
Aprenda mais sobre as Mudanças de Estados Físicos.
Constante de Equilíbrio Químico
A constante de equilíbrio, ou Kc, é uma expressão matemática que indica quais são as quantidades de produtos e reagentes no estado de equilíbrio. Essa relação é estabelecida entre as concentrações molares (mol/L) de reagentes e produtos presentes em uma reação elevadas aos seus respectivos expoentes.
Mol é uma unidade de medida utilizada para expressar a quantidade de matéria microscópica, como átomos e moléculas. Determina-se que 1 mol é igual a 6,02.1023 moléculas. Mol/L é a relação entre a quantidade de matéria do soluto, medida em mol, e o volume da solução em litros.
O Kc do equilíbrio químico acima será definido pela multiplicação das concentrações dos produtos dividido pela multiplicação entre as concentrações dos reagentes.
Todas as concentrações deverão ser elevadas aos seus respectivos coeficientes estequiométricos. Nesse caso temos:
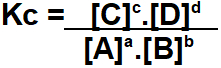
C e D representam as concentrações dos produtos e A e B são as concentrações dos reagentes. No esquema acima, a, b, c e d representam os coeficientes estequiométricos da equação balanceada. As concentrações são expressas através da unidade de medida mol/L.
Aprenda como tudo sobre cálculo e coeficiente estequiométrico.
Características da Constante de Equilíbrio
- Kc é uma constante para uma reação determinada em uma temperatura determinada. Se a temperatura da reação sofre alteração, o valor de Kc também se altera;
- Sólidos e líquidos puros, incluindo solventes, não são incluídos na expressão de equilíbrio;
- A reação precisa de estar balanceada e com os coeficientes escritos com o menor número inteiro possível para obter o valor correto para Kc.
Valores da Constante de Equilíbrio
- Se Kc tiver um valor alto (maior ou igual a 1000), o equilíbrio terá majoritariamente produtos;
- Se Kc tiver um valor baixo (menor ou igual a 0,001), o equilíbrio terá majoritariamente reagente;
- Se Kc tiver um valor entre 0,001 e 1000, o equilíbrio possui concentração significante tanto de reagentes quanto de produtos.
Exemplo
Analisar a reação no equilíbrio que ocorre entre o dióxido de enxofre e oxigênio para produzir trióxido de enxofre:
2SO2(g)+O2(g)⇋2SO3(g)
A reação está em equilíbrio a uma dada temperatura T, e as seguintes concentrações no equilíbrio são medidas:
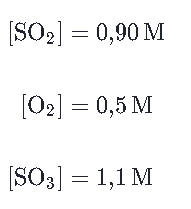
Podemos calcular Kc para a reação numa temperatura T através da resolução da seguinte expressão:
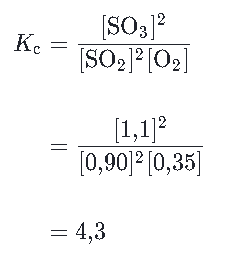
Como o valor da constante Kc está entre 0,001 e 1000, a reação possui concentrações de reagentes e produtos no equilíbrio.
Gráfico de Equilíbrio Químico
Pode-se expressar o equilíbrio químico em um gráfico utilizando as variáveis de velocidade e concentração em função do tempo. Obtém-se o equilíbrio químico quando as linhas de velocidade (e também de concentração) e tempo se tornam horizontais.
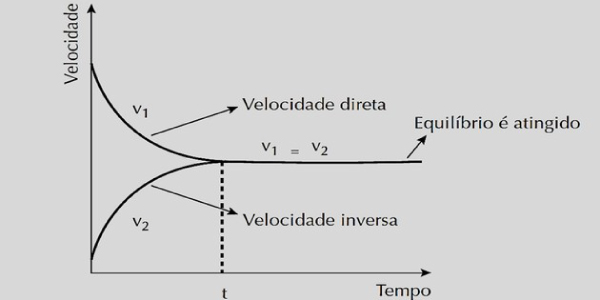
Velocidade x Tempo
À medida que v1 diminui, observa-se que os reagentes se transformam em produtos. Quando v2 aumenta, observa-se os produtos sendo formados. Ao atingir o equilíbrio químico, a velocidade das reações direta e inversa se tornam iguais.
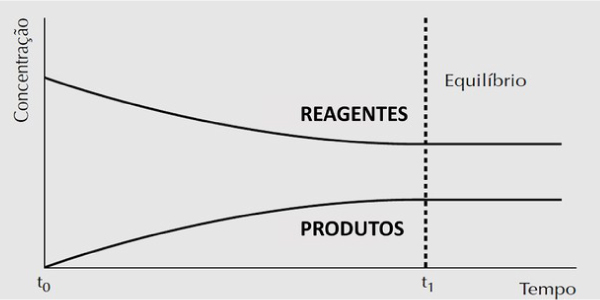
Concentração x Tempo
Observa-se que a concentração dos reagentes é máxima e ao longo do tempo diminui, uma vez que eles estão sendo transformados em produtos.
No entanto, a concentração dos produtos inicialmente é igual a zero, porque, no início da reação, só existem reagentes. A concentração dos produtos cresce à medida que estão sendo produzidos pela reação.
Quando o equilíbrio químico é atingido, a concentração de reagentes e produtos na reação é constante, entretanto, esse valores não são necessariamente iguais.
Perturbação do Equilíbrio Químico
O equilíbrio químico, em algum momento, pode ser perturbado. Esse acontecimento é chamado de deslocamento ou perturbação do equilíbrio onde, segundo o princípio de Le Chatelier, qualquer desequilíbrio na concentração, temperatura, e/ou pressão faz com que o sistema reaja buscando restabelecer o equilíbrio químico.
Fatores que perturbam o estado de equilíbrio:
- Alteração nas concentrações de reagentes ou produtos;
- Alteração na pressão do sistema (se houver componentes gasosos);
- Variação na temperatura (que faz com que não somente o equilíbrio seja perturbado, mas também altera o valor da constante).
Além de aprender o que é Equilíbrio Químico, você pode testar seus conhecimentos de outras matérias respondendo algumas questões que caíram em edições antigas do Exame em nosso simulado gratuito.
Gostou de aprender o que é Equilíbrio Químico? Queremos te ajudar também a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!