A isomeria é um fenômeno muito comum onde dois ou mais compostos possuem a mesma fórmula molecular, mas contêm diferentes propriedades e fórmulas estruturais diferentes.
Você sabe o que é Isomeria? Aprenda um pouco mais de química com esse artigo que o Beduka preparou para te ajudar a se preparar para o ENEM e outros vestibulares. Você também pode testar os seus conhecimentos sobre diversas matérias no nosso Simulado ENEM.
Já escrevemos um artigo explicando sobre o que é chuva ácida, fizemos um artigo sobre o que mais cai de Química na prova e também explicamos a definição de efeito estufa.
Além de química, outras matérias importantes no ENEM são física e matemática. Se prepare para a prova com nossas dicas de Matemática para o ENEM e veja também dicas de física para o ENEM.
O que é Isomeria?
A Isomeria é um fenômeno no qual duas ou mais substâncias de mesma fórmula molecular possuem propriedades (químicas e físicas) e fórmulas estruturais diferentes. Ela é extremamente importante para entendermos diferenças de propriedades como ponto de ebulição, por exemplo, entre compostos com mesma fórmula.
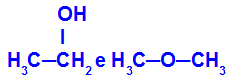
O etanol (esquerda) e o metoxietano (direita) apresenta, a fórmula molecular C2H6O. No entanto, sua estrutura molecular é diferente, logo, eles são isômeros.
Tipos de Isomeria
Isomeria Plana
A Isomeria Plana acontece quando a diferença que existe entre os compostos de mesma fórmula molecular pode ser percebida e explicada através da fórmula estrutural plana dos isômeros. A Isomeria Plana pode ser divida em:
- Isomeria de função;
- Isomeria de cadeia;
- Isomeria de posição;
- Isomeria metameria ou de compensação;
- Isomeria dinâmica ou tautomeria.
1. Isomeria de Função
É o tipo de isomeria plana no qual a diferença entre as substâncias está regulada na diferença entre as funções orgânicas às quais elas pertencem.
Ex: Propanona e propanal
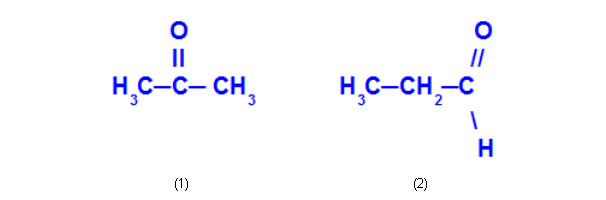
A propanona (1) pertence ao grupo das cetonas, e o propanal (2) pertence ao grupo dos aldeídos.
2. Isomeria de Cadeia
É a isomeria plana que acontece quando a diferença entre os isômeros está no tipo de cadeia, mesmo que as substâncias possuam a mesma função orgânica.
Ex: 2-metil-propano e butano
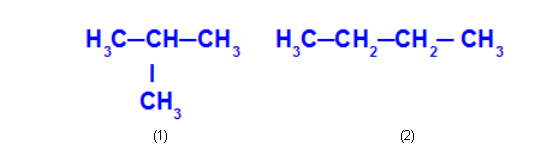
O 2-metil-propano (1) apresenta cadeia ramificada, e o butano (2) apresenta cadeia normal.
3. Isomeria de Posição
É o tipo de isomeria plana que ocorre quando os isômeros diferem quanto à posição de insaturações (ligações duplas ou triplas), do grupo funcional ou de ramificações.
Ex: 1-cloro-propano e 2-cloro-propano
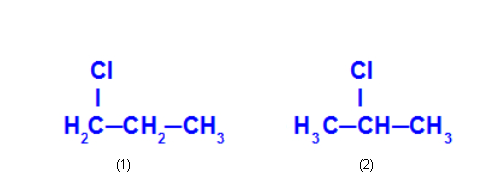
O 1-cloro-propano (1) possui o cloro posicionado no carbono 1, e o 2-cloro-propano (2) apresenta o cloro posicionado no carbono 2.
4. Isomeria de Metameria ou Compensação
É o tipo de isomeria plana que acontece quando a diferença entre os isômeros está na posição do heteroátomo na cadeia carbônica. Um heteroátomo é um átomo diferente de carbono e hidrogênio que se encontra ligado à dois carbonos em uma cadeia.
OBS.: Este tipo de isomeria é válido exclusivamente para cadeias heterogêneas.
Ex: Metoxipropano e Etoxietano
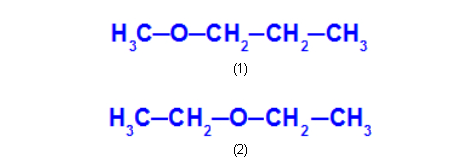
No metoxipropano (1), o oxigênio apresenta um radical com um carbono de um lado e três carbonos do outro. No etoxietano (2), o oxigênio apresenta um radical com dois carbonos de um lado e dois carbonos do outro.
5. Isomeria Dinâmica ou Tautomeria
Este é um caso específico da isomeria de função, tratando apenas quando os pares de isômero forem um aldeído e um enol ou uma cetona e um enol. Caracterizando a isomeria aldo-enólica ou ceto-enólica
Ex: Prop-2-en-1-ol e propanona
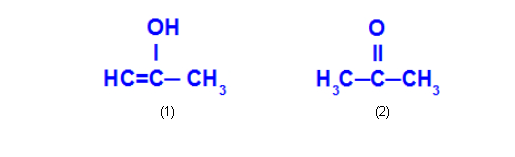
O Prop-2-en-1-ol (1) pertence ao grupo dos enóis, e a propanona (1) pertence ao grupo das cetonas, portanto, são isômeros de tautomeria.
Isomeria Espacial
A Isomeria espacial ocorre quando a diferença das fórmulas estruturais só é perceptível através da análise espacial da molécula. Há dois tipos de isomeria espacial:
1. Isomeria Geométrica
É o tipo de isomeria espacial que considera as estruturas espaciais das substâncias. A isomeria geométrica pode se dividir em dois grupos:
- Cis-trans
Acontece quando os dois ligantes de um carbono são estritamente iguais aos dois ligantes do outro carbono, seja na estrutura aberta ou fechada.
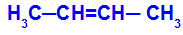
O isômero será chamado de Cis quando os ligantes iguais estiverem no mesmo plano.
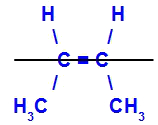
O isômero será chamado de trans quando os ligantes iguais estiverem em planos opostos.
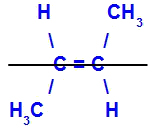
- E-Z
Acontece quando os dois ligantes de um carbono são diferentes dos dois ligantes do outro carbono, seja a estrutura aberta ou fechada.
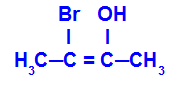
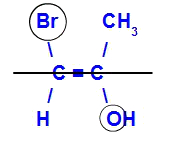
O isômero será chamado de E quando os ligantes de maior número atômico estiverem em planos opostos. Abaixo, o carbono da esquerda tem o Br com maior número atômico (35) e, no outro, há o oxigênio (8).
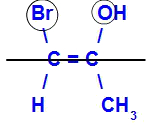
O isômero será chamado de Z quando os ligantes de maior número atômico estiverem no mesmo plano.
Para testar os seus conhecimentos sobre assunto, faça os nossos exercícios sobre isomeria geométrica.
2. Isomeria Óptica
Este tipo de isomeria espacial que ocorre apenas se a substância apresentar moléculas com carbono quiral (o que possui quatro ligantes diferentes) em suas estruturas.
A molécula com carbono quiral apresenta a capacidade de polarizar e desviar a luz. Se a luz se desvia para a direita, ele se chama isômero dextrogiro. Porém, se for para a esquerda se chama isômero levogiro.
Ex.: Ácidos lácticos
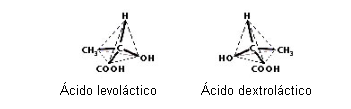
Os dois ácidos provocam o mesmo desvio angular, mas em direções opostos. As duas estruturas são fisicamente iguais, no entanto fisiologicamente e quimicamente são diferentes.
Para distingui-las, usamos a classificação dextrogiro e levogiro, uma vez que se tratam de isômeros opticamente ativos.
Uma substância que possui atividade óptica sempre apresenta isômeros ativos e isômeros inativos. Para determinar o número de isômeros ativos (IOA) e inativos (IOI) de um composto que apresenta carbono quiral, pode-se utilizar a fórmula:
IOA = 2n
IOI = 2n / 2
O Beduka te ajuda a passar no vestibular
Agora que você acabou de conferir uma explicação sobre o que é Isomeria, se prepare para o vestibular com outros conteúdos que o Beduka já disponibilizou. Aproveite para descobrir qual a importância dos biomas brasileiro, aprender mais sobre camadas da atmosfera terrestre ou até mesmo conferir o que é a globalização.
O Beduka é um buscador de universidades e cursos superiores reconhecidos pelo Ministério da Educação (MEC) que surgiu em 2017. Aqui em nosso site o estudante pode conferir diversas informações para encontrar a melhor faculdade para a graduação que deseja fazer.
Se você estiver se preparando para o ENEM, pode ainda testar os seus conhecimentos respondendo algumas questões que caíram em edições antigas do Exame em nosso simulado gratuito.
Gostou de descobrir o que é Isomeria? Queremos te ajudar também a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





