A Calorimetria é área da física que estuda as relações de troca de calor e temperatura entre corpos. Trata desde os tipos de transmissão de calor (condução, irradiação e convecção), até as fórmulas para descobrir o quanto precisamos aquecer um sólido para mudar seu estado físico. Leia nosso resumo e faça os melhores Exercícios sobre Calorimetria selecionados para você.
Quando você terminar os Exercícios sobre Calorimetria, faça nosso Simulado Enem. Coloque em prática todo o seu estudo, escolhendo as matérias que deseja treinar.
Como uma das matérias mais cobradas no ENEM pode explicar seu picolé derretendo na praia?
É isso que vamos te contar neste artigo!!!
O calor do meio ambiente passa para o picolé, fazendo com que sua temperatura suba.
Assim ele sai do estado sólido e vai para o líquido.
Qual o processo que explica isso?
Vamos mais a fundo nessa investigação e ainda te dar a oportunidade de fazer os melhores Exercícios sobre Calorimetria do Brasil.
O que é Calorimetria?
A Calorimetria é a área da física que estuda as relações de troca de calor e temperatura entre corpos. Trata desde os tipos de transmissão de calor (condução, irradiação e convecção), até as fórmulas para descobrir o quanto precisamos aquecer um sólido para mudar seu estado físico.
O que é o calor?
Calor é transferência de energia de um corpo para o outro. Isso ocorre para diferença de temperatura entre eles.
A transferência sempre vai do corpo de maior temperatura para o com menor temperatura, no objetivo de equilibrar a temperatura de ambos. Então…
Quando estamos saboreando um picolé na praia, o picolé está em uma temperatura muito inferior ao do ambiente, logo…
O ambiente transfere energia para o picolé, que tem um aumento de temperatura e derrete.
Quais as fórmulas da calorimetria?
A fórmula utilizada para calcular o trânsito de calor é a seguinte:
Q = m . c . ΔT
Sendo que:
Q: quantidade de calor sensível (J ou cal)
m: massa do corpo (kg ou g)
c: calor específico (J/kg.ºC ou cal/g.ºC)
ΔT: variação de temperatura (ºC), ou seja, a temperatura final menos a temperatura inicial.
O que é o calor específico?
O calor específico é a constante que indica a proporção da: quantidade de calor que 1 kg da substância necessita para elevar sua temperatura em 1°. Portanto…
Cada tipo de material vai ter sua constante de calor específico.

O “c” da água, por exemplo, é 1 J/Kg.°C. Isso significa que…
É preciso um Joule para fazer 1kg de água aumentar sua temperatura em 1 grau celsius.
O que é o capacidade térmica?
É uma grandeza que representa a quantidade de calor presente em um determinado corpo em relação à variação de temperatura sofrida por ele.
Para calcular a capacidade térmica, utiliza-se as seguintes fórmulas:
C = Q/Δθ
ou
C = m . c
Sendo que:
C: capacidade térmica (cal/°C ou J/K)
Q: quantidade de calor (cal ou J)
Δθ: variação de temperatura (°C ou K)
m: massa (g ou Kg)
c: calor específico (cal/g°C ou J/Kg.K)
O que é o calor latente?
É uma grandeza que representa a quantidade de calor recebido ou cedido para que um corpo mude o seu Estado Físico.
Podemos calcular o calor Latente da seguinte forma:
Q = m . L
Sabendo que:
Q: quantidade de calor (cal ou J)
m: massa (g ou Kg)
L: calor latente (cal/g ou J/Kg)
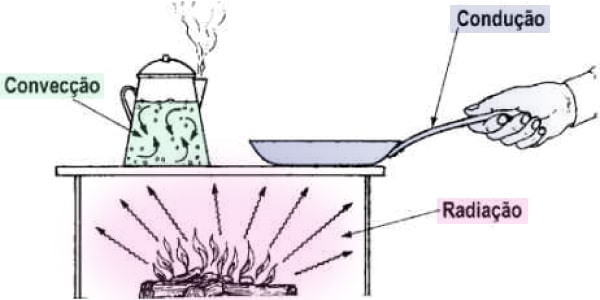
Quais as formas de transferência de calor?
- Condução: a transmissão de calor ocorre por meio do contato entre os corpos;
- Convecção: a transmissão de calor ocorre quando há uma mudança na densidade que cria um movimento no interior do líquido ou do gás, fazendo com que essa movimentação de sobe e desce gere correntes de convecção responsáveis pela troca de temperatura.
- Irradiação: ocorre quando a transferência de calor se dá por meio de ondas eletromagnéticas. Esse tipo de transmissão não necessita de um meio material para acontecer.
Agora você consegue entender como uma das matéria mais cobradas do ENEM explica o seu picolé derretendo na praia. Sendo assim…
Vamos pular da teoria para a prática, resolvendo os Exercícios sobre Calorimetria.
Exercícios sobre calorimetria com Gabarito
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Agora que tal testar seu conhecimento com Exercícios sobre Gravitação Universal?
Aproveite e baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (ENEM 2013) Em um experimento foram utilizadas duas garrafas PET, uma pintada de branco e a outra de preto, acopladas cada uma a um termômetro. No ponto médio da distância entre as garrafas, foi mantida acesa, durante alguns minutos, uma lâmpada incandescente. Em seguida a lâmpada foi desligada. Durante o experimento, foram monitoradas as temperaturas das garrafas:
I- enquanto a lâmpada permaneceu acesa e
II- após a lâmpada ser desligada e atingirem equilíbrio térmico com o ambiente. Termômetro
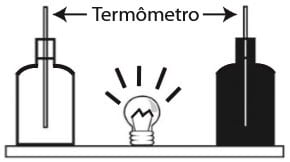
Figura – questão 71 do Enem 2013
A taxa de variação da temperatura da garrafa preta, em comparação à da branca, durante todo experimento, foi
a) igual no aquecimento e igual no resfriamento.
b) maior no aquecimento e igual no resfriamento.
c) menor no aquecimento e igual no resfriamento.
d) maior no aquecimento e menor no resfriamento.
e) maior no aquecimento e maior no resfriamento.
Questão 2 – (ENEM 2013) Aquecedores solares usados em residências têm o objetivo de elevar a temperatura da água até 70 °C. No entanto, a temperatura ideal da água para um banho é de 30 °C. Por isso, deve-se misturar a água aquecida com a água à temperatura ambiente de um outro reservatório, que se encontra a 25 °C.
Qual a razão entre a massa de água quente e a massa de água fria na mistura para um banho à temperatura ideal?
a) 0,111.
b) 0,125.
c) 0,357.
d) 0,428.
e) 0,833.
Questão 3 – (UFPR) Para aquecer 500 g de certa substância de 20 ºC para 70 ºC, foram necessárias 4000 calorias. A capacidade térmica e o calor específico valem respectivamente:
a) 8 cal/ ºC e 0,08 cal/g .ºC
b) 80 cal/ ºC e 0,16 cal/g. ºC
c) 90 cal/ ºC e 0,09 cal/g. ºC
d) 95 cal/ ºC e 0,15 cal/g. ºC
e) 120 cal/ ºC e 0,12 cal/g. ºC
Questão 4 – (Makenzie – SP) Em uma manhã de céu azul, um banhista na praia observa que a areia está muito quente e a água do mar está muito fria. À noite, esse mesmo banhista observa que a areia da praia está fira e a água do mar está morna. O fenômeno observado deve-se ao fato de que:
a) a densidade da água do mar é menor que a da areia.
b) o calor específico da areia é menor que o calor específico da água.
c) o coeficiente de dilatação térmica da água é maior que o coeficiente de dilatação térmica da areia.
d) o calor contido na areia, à noite, propaga-se para a água do mar.
e) a agitação da água do mar retarda seu resfriamento.
- Ufa! Estamos quase no fim, continue e faça os 3 últimos Exercícios sobre Calorimetria.
Questão 5 – (FUVEST – SP) Um amolador de facas, ao operar um esmeril, é atingido por fagulhas incandescentes, mas não se queima. Isso acontece porque as fagulhas:
a) tem calor específico muito grande.
b) tem temperatura muito baixa.
c) tem capacidade térmica muito pequena.
d) estão em mudança de estado.
e) não transportam energia.
Questão 6 – (UEL 2012) O homem utiliza o fogo para moldar os mais diversos utensílios. Por exemplo, um forno é essencial para o trabalho do ferreiro na confecção de ferraduras. Para isso, o ferro é aquecido até que se torne moldável. Considerando que a massa de ferro empregada na confecção de uma ferradura é de 0,5 kg, que a temperatura em que o ferro se torna moldável é de 520 ºC e que o calor específico do ferro vale 0,1 cal/gºC, assinale a alternativa que fornece a quantidade de calor, em calorias, a ser cedida a essa massa de ferro para que possa ser trabalhada pelo ferreiro. Dado: temperatura inicial da ferradura: 20 ºC.
a) 25
b) 250
c) 2500
d) 25000
e) 250000
Questão 7 – (PUCRJ 2013) Um líquido é aquecido através de uma fonte térmica que provê 50,0 cal por minuto. Observa-se que 200 g deste líquido se aquecem de 20,0 °C em 20,0 min. Qual é o calor específico do líquido, medido em cal/(g °C)?
a) 0,0125
b) 0,25
c) 5,0
d) 2,5
e) 4,0
- Parabéns, chegou ao fim dos Exercícios sobre Calorimetria. Confira agora o Gabarito:
Gabarito dos Exercícios sobre Calorimetria
Exercício resolvido da questão 1 –
Alternativa correta: e) maior no aquecimento e maior no resfriamento.
Exercício resolvido da questão 2 –
Alternativa correta: b) 0,125.
Exercício resolvido da questão 3 –
Alternativa correta: b) 80 cal/ ºC e 0,16 cal/g. ºC
Exercício resolvido da questão 4 –
Alternativa correta: b) o calor específico da areia é menor que o calor específico da água.
Exercício resolvido da questão 5 –
Alternativa correta: c) tem capacidade térmica muito pequena.
Exercício resolvido da questão 6 –
Alternativa correta: d) 25000
Exercício resolvido da questão 7 –
Alternativa correta: b) 0,25
Estude para o Enem com o Simulado Beduka. É gratuito!
Gostou dos nossos Exercícios sobre Calorimetria? Compartilhe com os seus amigos e comente abaixo sobre as áreas que você deseja mais explicações.
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.





