A Calorimetria é o ramo da física que estuda as relações de troca de calor e temperatura entre corpos. Trata desde os tipos de transmissão de calor – condução, irradiação e convecção – até as fórmulas para descobrir quanto precisamos aquecer um sólido para mudar seu estado físico.
Neste artigo sobre o que é Calorimetria, você encontrará:
- O que é Calorimetria: introdução e diferença entre Calor latente e Calor sensível
- Calor, Temperatura, Calor específico, Capacidade térmica e Fluxo
- Fórmulas e Equação Fundamental da Calorimetria
- Tipos de condução de calor: Condução, Irradiação e Convecção
- Simulado online e gratuito de qualidade é só no Beduka! Você pode até personalizar com as matérias que preferir!
O que é Calorimetria? Veja os conceitos mais importantes
A Calorimetria é, antes de mais nada, uma ramificação da Termologia. A termologia é a área da física que estuda tudo o que envolve temperatura, já a Calorimetria se aprofunda na parte específica que se trata do calor.
Pensou que calor e temperatura eram a mesma coisa, né? Não mesmo! Nós veremos a seguir qual é a diferença entre calor e temperatura.
Para ficar mais claro, saiba que na Calorimetria vamos estudar trocas de energia térmica que ocorrem entre dois ou mais corpos e assim é possível saber qual é a temperatura de equilíbrio de um sistema ou qual é a quantidade de energia térmica necessária para que a temperatura varie ou haja mudança de estado físico.
Definição de Temperatura
A temperatura é uma grandeza física que mede a agitação das moléculas de um corpo.
Por mais que não vejamos, tudo o que conhecemos é constituído de átomos – partículas MUITO pequenas. Esses átomos formam ligações entre si à base de energia. Portanto, tudo possui vibração, por mais que não possamos sentir.
Quanto maior a agitação das moléculas, maior a temperatura do corpo. Da mesma forma, quanto menor a agitação das moléculas, menor a temperatura do corpo.
O Sistema Internacional de Unidades (SI) foi criado para padronizar as medidas. Antigamente cada povo tinha sua forma de medir as coisas, alguns mediam com pés, “tal coisa tem 3 pés de altura”, e outros com nós.
Também a medição de temperatura era variada. Com isso, na hora de compartilhar as descobertas e cálculos científicos, era uma confusão para entender!
Assim, foi definido pelo SI que podemos usar 3 unidades de medida para temperatura: Kelvin (K), Fahrenheit (ºF) e Celsius (ºC).
Existem uma fórmulas para fazer as conversões de uma unidade para a outra, duas a duas. No caso de Celsius para Kelvin, basta somar o número 273 (arredondado). Para converter de Kelvin para Celsius, subtrai-se 273.
No caso de Celsius para Fahrenheit, existe uma fórmula própria: °C / 5 = (°F – 32) / 9
O que é Calor?

Já o conceito de calor é a energia térmica em movimento, é a transferência de energia de um corpo para o outro.
- É importante ressaltar que o calor sempre corre no sentido do corpo de maior temperatura para o corpo de menor temperatura.
Se houver um copo de suco com gelo, é incorreto dizer que o gelo diminuiu a temperatura do suco, no sentido de que passou “temperatura fria”. O certo é que o suco esquentou o gelo, portanto o suco esfria (perdeu calor) e o gelo derrete (recebeu calor).
Assim, podemos dizer que enquanto houver transferência de temperatura, haverá calor.
Em sistemas isolados termicamente (fechados), essas trocas de calor irão ocorrer até que seja estabelecido o equilíbrio térmico e, nesta situação, a temperatura final será a mesma para todos os corpos envolvidos.
Logo, a quantidade de calor cedida será igual a quantidade de calor absorvida. Em outras palavras, a energia total do sistema se conserva.
Este fato pode ser representado pela fórmula:
Qr(c) + Q(a) = 0
Pois o calor calor cedido é colocado com sinal negativo e o calor absorvido é com sinal positivo.
Ainda podemos representar por: ∑Q = Q1+Q2+Q3…Qn = 0 ou simplesmente: ΣQ=0. Lê-se que somatório de todas as quantidades de calor é igual a zero.
A grandeza que define essa energia térmica em trânsito (calor) é chamada de quantidade de calor (Q). No Sistema Internacional (SI), a unidade de quantidade de calor é o joule (J). Contudo, usa-se também uma unidade chamada de caloria (cal).
Essas unidades possuem a seguinte relação: 1 cal = 4,1868 J
Diferença entre Calor latente e Calor sensível
Essa transferência de energia térmica, ou seja, o calor, pode produzir dois efeitos diferentes no corpo que a recebe:
- Quando produz uma mudança no seu estado físico, chamamos de Calor Latente:
A quantidade de calor latente (Q) é igual ao produto da massa do corpo (m) e de uma constante (L).
Ou seja: Q = m . L
Uma constante é um valor fixo que é dado de acordo com o seu contexto. Exemplo: a constante gravitacional “g” vale aproximadamente 10m/s². Isso significa que em qualquer cálculo que fizermos e que envolva a gravidade na terra, esse valor será utilizado.
Neste caso, a constante de proporcionalidade “L” é chamada “calor latente de mudança de fase” e se refere a quantidade de calor que 1g da substância calculada necessita para mudar de uma fase para outra. Além da natureza da substância, este valor numérico também depende de cada mudança de estado físico.
- Quando produz uma mudança na sua temperatura, chamamos de Calor Sensível:
O calor sensível é aquele que vem primeiro a nossa mente e está mais ligado ao nosso cotidiano. Também é o que mais lidamos em matéria de calorimetria.
Assim como o “L” é a constante do calor latente, a constante do calor sensível é o “c”, mais conhecido como Calor Específico. Ele é o responsável por gerar a famosa Equação Fundamental da Calorimetria.
Veja no próximo tópico:
Definição de Calor específico e Equação Fundamental da Calorimetria
O calor específico é a constante que indica a proporção: quantidade de calor que 1 kg da substância necessita para elevar sua temperatura em 1°.
Portanto, cada tipo de material vai ter sua constante de calor específico.
O “c” da água, por exemplo é 1 J/Kg.°C. Isso significa que é preciso um Joule para fazer 1kg de água aumentar sua temperatura em 1 grau celsius.
Portanto, a quantidade de calor sensível recebida ou cedida por um corpo pode ser calculada através da Equação Fundamental da Calorimetria:

Capacidade térmica: definição, como calcular e diferença do calor específico
A capacidade térmica ( C ) é a quantidade de calor que um corpo precisa receber ou ceder para variar sua temperatura em 1 grau.
- Observe que a definição de calor específico é semelhante, mas não são coisas iguais.
A diferença é que o calor específico é uma constante de proporcionalidade 1 J para 1 grau para 1 Kg. Ela é uma ferramenta, um componente do cálculo para manter a proporção da conta.
Já a Capacidade Térmica é medida de qual o calor necessário para elevar a substância a uma temperatura qualquer, que eu estipulo de acordo com contexto.Isso é feito pelo cálculo desenvolvido, utilizando do “c”. Portanto, seu valor está relacionado ao corpo, levando em consideração a sua massa e a substância de que é feito.
Podemos calcular a capacidade térmica de um corpo, através da seguinte fórmula:
Sabemos que a quantidade de calor (Q) é definida por m.c.ΔT, e que queremos saber qual será sua quantidade em relação a uma temperatura dada pelo contexto. Tudo isso resultará na Capacidade térmica, logo:
C = Q / ΔT
Substituindo o Q por sua fórmula de equivalência, teremos a nova equação:
C = m.c.ΔT / ΔT
Simplificando, chegamos à equação final da Capacidade Térmica:
- C = m.c
Sendo:
C: capacidade térmica (J/ºC ou cal/ºC)
m: massa (kg ou g)
c: calor específico (J/kg.ºC ou cal/g.ºC)
Exemplo de questão sobre calorimetria: calor e capacidade térmica
- Em uma panela foram colocados 1,5 kg de água em temperatura ambiente (20 ºC). Ao ser aquecida, sua temperatura passa para 85 ºC. Considerando que o calor específico da água é de 1 cal/g ºC, calcule:
- A quantidade de calor recebida pela água para atingir essa temperatura
- A capacidade térmica dessa porção de água
Resolução
a) Para encontrar o valor da quantidade de calor (Q), devemos substituir todos os valores informados na equação fundamental da calorimetria.
Contudo, devemos prestar atenção nas unidades de medida!!!
No caso, a massa de água foi informada em quilograma, mas a unidade do calor específico foi dado em cal/g ºC. Portanto, devemos transformar essa unidade para grama.
m = 1,5 kg = 1500 g
ΔT = 85 – 20 = 65 ºC
c = 1 cal/g ºC
Q = 1500 . 1 . 65
Q = 97 500 cal
- Resposta final: Q = 97,5 kcal
b) O valor da capacidade térmica (C) é encontrado substituindo os valores da massa da água e o seu calor específico na fórmula. Mais uma vez, devemos nos atentar às unidades de medida e usar o valor da massa em gramas.
C = 1. 1500
- Resposta final: C = 1500 cal/ ºC
IMPORTANTE:
Todas essas fórmulas devem ser decoradas pelo aluno! A não ser que o professor seja bonzinho e coloque a fórmula na prova… mas isso é raro!
Contato térmico: Tipos de condução na calorimetria
Sem mais fórmulas e para finalizar, precisamos entender a definição de Contato Térmico.
O contato térmico ocorre em qualquer meio que permita a transferência de calor entre 2 ou mais corpos. Existem três formas de isso ocorrer: por contato, convecção e indução. Vamos compreender cada uma delas:
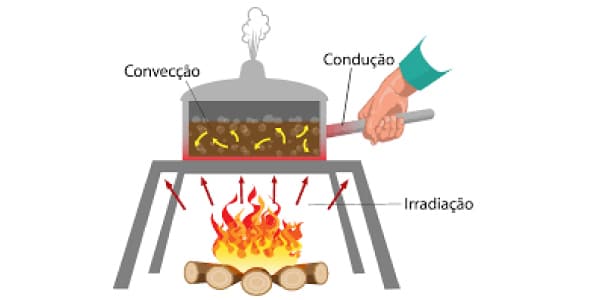
Condução
Na condução térmica, a propagação do calor ocorre através do contato, que gera agitação térmica dos átomos e molécula. Essa agitação é transmitida ao longo do corpo, enquanto existir diferença de temperatura entre as suas partes.
Portanto, necessita de um meio material para ocorrer. Assim podemos dizer que ela é mais efetiva nos sólidos do que nos corpos fluidos.
Além disso, existem aqueles que permitem que transmissão ocorra com maior facilidade, são os chamados condutores de calor, como os metais de uma maneira geral.
Contudo, há materiais que dificultam a ocorrência de calor, e são chamados de isolantes térmicos, como o isopor e a madeira.
- Exemplo de condução:
Quando utilizamos uma colher de metal para mexer em uma panela quente, logo a colher esquenta e queima nossa mão. Por isso, é muito comum que as pessoas prefiram colheres de madeira, para evitar esse aquecimento rápido.
Convecção
Na convecção térmica, a transferência de calor acontece por causa da diferença de densidade, ou seja, é comum em líquidos e gases.
Quando a substância é aquecida, a densidade diminui, e quando ela é resfriada, a densidade aumenta.
Observe que em um incêndio as pessoas se abaixam para andar e tentar sair do local cheio de fumaça, pois o ar aquecido diminui a densidade, logo, sobe.
Já no inverno, vemos a neblina descendo pelas montanhas, pois o ar frio é mais denso, então desce.
Essa mudança na densidade cria um movimento no interior do líquido ou do gás e essa movimentação de sobe e desce gera o que chamamos de correntes de convecção
- Exemplo de convecção
As correntes de convecção explicam o aquecimento da água numa panela, onde a água que está mais próxima do fogo, sobe, enquanto a que está fria, na superfície, desce.
As chuvas da floresta amazônica e as brisas marinhas também são formadas por esse processo.
Irradiação
A Irradiação térmica ocorre com a transferência de calor por meio de ondas eletromagnéticas. Este tipo de transmissão ocorre sem a necessidade de um meio material.
Ao atingir um corpo, parte da radiação é absorvida e parte é refletida. A quantidade que é absorvida aumenta a energia cinética das moléculas do corpo, gerando maior vibração e energia térmica.
Os corpos escuros absorvem a maior parte da radiação ao passo que os corpos claros refletem a maior parte. Portanto, os corpos escuros aumentam muito mais rapidamente sua temperatura do que os corpos de cor clara, quando colocados sob exposição do sol.
- Exemplo de Irradiação
Daí surge a ideia de utilizarmos roupas mais escuras no inverno e roupas mais claras no verão!
Como ondas eletromagnéticas temos o clássico exemplo da luz, portanto, a irradiação solar que incide no planeta Terra é um ótimo exemplo.
Gostou do nosso artigo sobre o que é Calorimetria? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!