Cinética química é uma área que estuda a velocidade das reações químicas e os fatores que influenciam essas reações. Leia nosso resumo para relembrar e treine com os melhores exercícios sobre cinética química. Tem gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- O que é Cinética Química?
- Velocidade das reações.
- Classificação das reações químicas.
- Lista de exercícios sobre cinética química!
- Gabarito dos exercícios de cinética química.
Quando você terminar as atividades sobre cinética química, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que é Cinética Química?
Cinética química é uma área que estuda a velocidade das reações químicas e os fatores que influenciam essas reações.
Reações químicas são, basicamente, um conjunto de fenômenos em que duas ou mais substâncias reagem entre si, formando um novo composto.
Equação química é a representação gráfica de uma reação química, onde os reagentes aparecem no primeiro membro e os produtos, no segundo.

- São mais de 200 resumos no Instagram do Beduka!
Velocidade das Reações Químicas
O que determina a velocidade de uma reação química é o tempo em que os reagentes são consumidos para formar produtos.
A velocidade de uma reação pode ser representada tanto pelo consumo de um reagente, quanto pela geração de um produto.
Antes de ocorrer a reação química temos uma quantidade máxima de reagentes e nenhum produto. Quando um dos reagentes é totalmente consumido, os produtos se formam e a reação termina.
Classificação das reações químicas
Para entender melhor a cinética química é preciso saber que as reações químicas podem ser classificadas de 3 maneiras:
- Reações rápidas: São aquelas que ocorrem instantaneamente, em questão de microssegundos. Um exemplo é a queima do gás de cozinha.
- Reações moderadas: São aquelas que levam de minutos a horas para serem finalizadas. Um exemplo é a queima do papel.
- Reações Lentas: São aquelas que podem durar séculos, pois os reagentes combinam-se lentamente. Um exemplo é a formação do petróleo.
Aprofunde mais o seu estudo em Cinética Química lendo nosso artigo sobre o tema.
Exercícios sobre Cinética Química
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1. (ENEM)
Alguns fatores podem alterar a rapidez das reações químicas. A seguir destacam-se três exemplos no contexto da preparação e da conservação de alimentos:
1. A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos.
2. Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão.
3. Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas
a) Temperatura, superfície de contato e concentração.
b) Concentração, superfície de contato e catalisadores.
c) Temperatura, superfície de contato e catalisadores.
d) Superfície de contato, temperatura e concentração.
e) Temperatura, concentração e catalisadores.
Questão 2. (Fuvest)
O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
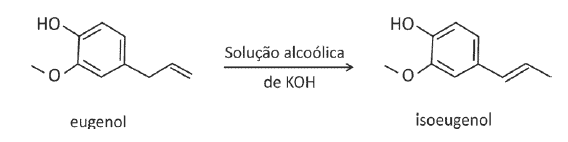
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
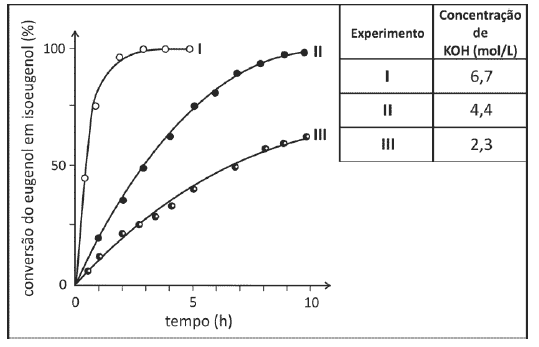
Analisando-se o gráfico, pode-se concluir corretamente que
a) a isomerização de eugenol em isoeugenol é exotérmica.
b) o aumento da concentração de KOH provoca o aumento da velocidade da reação de isomerização.
c) o aumento da concentração de KOH provoca a decomposição do isoeugenol.
d) a massa de isoeugenol na solução, duas horas após o início da reação, era maior do que a de eugenol em dois dos experimentos realizados.
e) a conversão de eugenol em isoeugenol, três horas após o início da reação, era superior a 50% nos três experimentos.
Questão 3. (PUC-SP)
Considere uma reação genérica em que os reagentes D e G transformam-se no produto J. A cinética dessa reação pode ser estudada a partir do gráfico a seguir que representa a entalpia de reagentes e produtos, bem como das espécies intermediárias formadas durante o processo. No gráfico, estão representados os caminhos da reação na presença e na ausência de catalisador.
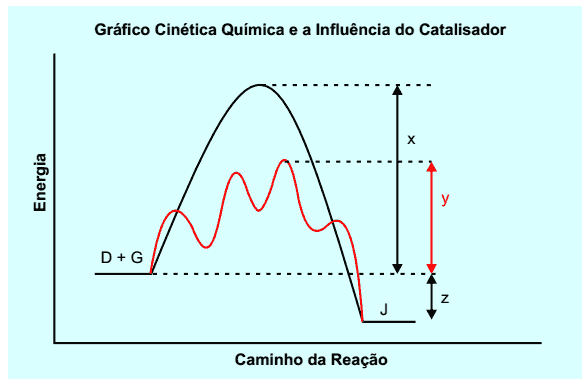
Um aluno ao analisar esse gráfico fez algumas afirmações a respeito da reação D + G → J:
I. z representa a variação de entalpia (ΔH) dessa reação.
II. y representa a energia de ativação dessa reação na presença de catalisador.
III. x + z representa a energia de ativação dessa reação na ausência de catalisador.
IV. Essa reação corresponde a um processo endotérmico.
Estão corretas apenas as afirmações
a) I e II.
b) I e III.
c) II e III.
d) II e IV.
e) I, II e IV.
- Muito bem! Você está quase na metade das questões de cinética química!
Questão 4. (UFF)
Considere a reação:
M (g) + N (g) → O (g)
Observa-se experimentalmente que, dobrando-se a concentração de N, a velocidade de formação de O quadruplica; e, dobrando-se a concentração de M, a velocidade da reação não é afetada. A equação da velocidade v dessa reação é:
a) v = k[M]².
b) v = k[N]².
c) v = k[M].
d) v = k[M][N].
e) v = k[M][N]².
Questão 5. (Fuvest)
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração. O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela). O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
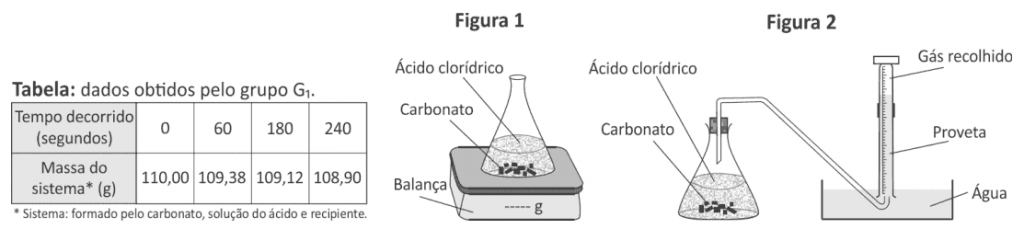
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
a) 0,14; 0,20 e 0,25.
b) 0,14; 0,34 e 0,60.
c) 0,34; 0,48 e 0,60.
d) 0,34; 0,48 e 0,88.
e) 0,62; 0,88 e 1,10.
- Ufa, estamos quase lá! Faça os dois últimos exercícios sobre cinética química!
Questão 6. (Unesp)
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo (luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reação bioquímica é gerado um produto em um estado eletronicamente excitado (oxiluciferina*). Este produto, por sua vez, desativa-se por meio da emissão de luz visível, formando o produto no estado normal ou fundamental (oxiluciferina). Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bioluminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados, responsáveis pela emissão de luz na cor verde ou na cor vermelha.
O esquema ilustra o mecanismo geral da reação de bioluminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados, responsáveis pela emissão de luz na cor verde ou na cor vermelha.
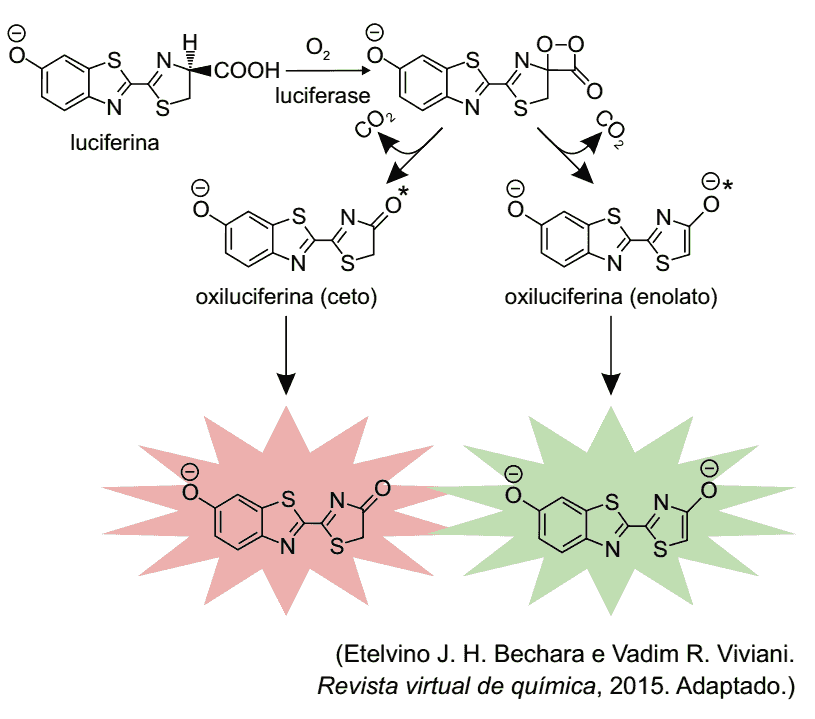
A partir das informações contidas no texto, é correto afirmar que a enzima luciferase
a) aumenta a energia de ativação da reação global de formação da oxiluciferina.
b) é um dos produtos da reação.
c) é responsável pela emissão de luz.
d) é o intermediário da reação, a partir do qual se originam os produtos.
e) atua como catalisador, pois interfere na reação sem ser consumida no processo.
Questão 7. (PUC-RS)
Relacione os fenômenos descritos na coluna I com os fatores que influenciam sua velocidade mencionados na coluna II.
Coluna I
1 – Queimadas alastrando-se rapidamente quando está ventando;
2 – Conservação dos alimentos no refrigerador;
3 – Efervescência da água oxigenada na higiene de ferimentos;
4 – Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
Coluna II
A – superfície de contato
B – catalisador
C – concentração
D – temperatura
A alternativa que contém a associação correta entre as duas colunas é
a) 1 – C; 2 – D; 3 – B; 4 – A.
b) 1 – D; 2 – C; 3 – B; 4 – A.
c) 1 – A; 2 – B; 3 – C; 4 – D.
d) 1 – B; 2 – C; 3 – D; 4 – A.
e) 1 – C; 2 – D; 3 – A; 4 – B.
- Parabéns, você fez todos os exercícios de cinética química!
Gabarito dos Exercícios de Cinética Química
Exercício resolvido da questão 1 –
Alternativa correta: c) Temperatura, superfície de contato e catalisadores.
Exercício resolvido da questão 2 –
Alternativa correta: b) o aumento da concentração de KOH provoca o aumento da velocidade da reação de isomerização.
Exercício resolvido da questão 3 –
Alternativa correta: a) I e II.
Exercício resolvido da questão 4 –
Alternativa correta: b) v = k[N]².
Exercício resolvido da questão 5 –
Alternativa correta: c) 0,34; 0,48 e 0,60.
Exercício resolvido da questão 6 –
Alternativa correta: e) atua como catalisador, pois interfere na reação sem ser consumida no processo.
Exercício resolvido da questão 7 –
Alternativa correta: a) 1 – C; 2 – D; 3 – B; 4 – A.
Gostou dos nossos exercícios de cinética química? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, mensalidade e muito mais.
Experimente agora!





