A Isomeria Geométrica é um tipo de Isomeria Espacial que diferencia os isômeros analisando sua estrutura tridimensional. Primeiro, traça-se uma linha horizontal e observa se os ligantes iguais estão no mesmo plano (Cis) ou em planos opostos (Trans). Há certas condições para que ocorra em cadeias abertas insaturadas ou nas cadeias cíclicas.
Neste texto sobre Isomeria Geométrica, você encontrará os tópicos abaixo. Clique em um deles para ir diretamente ao conteúdo:
- Introdução: o que é Isomeria? E a do tipo Espacial?
- O que é Isomeria Geométrica?
- Condição para cadeias abertas + Exemplo.
- Condição para cadeias fechadas + Exemplo.
- Diferença entre Cis e Trans, E e Z.
- Ligantes de cada carbono diferentes entre si + Exemplo.
- Aplicação da isomeria e diferentes propriedades dos isômeros + Exemplo.
- Casos em que não ocorre Isomeria Geométrica.
- Estudando para as provas? Conheça O melhor Simulado do Brasil! Ele pode ser personalizado com as matérias que você mais precisa!
Introdução: o que é Isomeria?
Os compostos químicos são feitos de vários elementos que podem ser representados de diversas formas. Assim, cada molécula possui uma quantidade e combinação específicas, além de uma estrutura própria.
Chamamos de Isômeros aqueles compostos que possuem a mesma fórmula molecular (indica elementos e quantidade). Exemplo disso são o propeno e o ciclopropano, ambos representados por C3H6.
Apesar disso, sabemos que são compostos diferentes. A Isomeria é a área da química que vai fazer esse estudo de diferenciação dos isômeros. Existem vários outros aspectos que nos permite ver a diferença, logo, existem tipos de Isomeria.
Isomeria Espacial
Nesse caso, estamos falando da Isomeria Espacial. Ela diferencia compostos de mesma fórmula molecular ao analisar suas diferentes fórmulas estruturais (a estrutura 3D, visão espacial).
Há dois tipos de Isomeria Espacial:
- Isomeria geométrica: analisamos suas estruturas espaciais. Só é possível perceber essa isomeria se traçarmos um plano imaginário e ver como as partes estão dispostas em relação a ele.
- Isomeria óptica: analisamos o comportamento das substâncias sob um feixe de luz polarizada. Significa que alguns isômeros desviam-se para a direita (dextrógiros) e outros para a esquerda (levógiros), diferenciando-os já que ficam espelhados.
Os isômeros com diferenças espaciais são chamados genericamente de estereoisômeros.
Quando analisados pela espacial geométrica, são chamados de diastereoisômeros.
Quando analisados pela óptica, são chamados de enantiômeros.
O que é Isomeria Geométrica?
A Isomeria Geométrica também pode ser chamada de Cis-trans ou Estereoisomeria.
Ela é um tipo de Isomeria Espacial que compara a posição dos ligantes de dois átomos de carbono. Essa avaliação é feita a partir de um plano imaginário e olha para a tridimensionalidade da molécula.
O plano imaginário é simplesmente traçar uma linha horizontal sobre a ligação dupla e observar quais ligantes ficam acima e quais ficam abaixo.
Ela só ocorre em moléculas alifáticas (cadeia aberta) com dupla ligação entre carbonos, ou nas cíclicas (cadeia fechada).
Se a molécula tiver mais de uma ligação dupla entre carbonos, ela poderá apresentar mais de um isômero. Se houver uma insaturação entre C e outro elemento, não se trata dessa isomeria.
Essa isomeria acontece justamente porque a ligação dupla entre os Carbonos não permite que eles girem um em relação ao outro. A única coisa que pode girar é o ligante de cada carbono, que tem ligação simples.
Isomeria Cis-trans em cadeia aberta
Como foi dito anteriormente, a isomeria geométrica só ocorre em cadeias abertas insaturadas, ou seja, com ligações duplas entre carbonos.
Além disso, é necessário que os ligantes de um mesmo C sejam diferentes. Caso contrário, trocá-los de posição não muda o tipo de elemento, então temos uma equivalência e não queremos isso (precisamos diferenciar)!
Por fim, é preciso que os dois carbonos tenham pelo menos um ligante em comum entre si. Isso significa que o primeiro carbono tem dois ligantes (x e y) e o segundo carbono precisa ter ao menos o x, y ou ambos.
Quando os átomos de uma molécula tem essas duas condições, dizemos que há duas possibilidades de isômeros. Isso é o mesmo que dizer “um par de diastereoisômeros”.
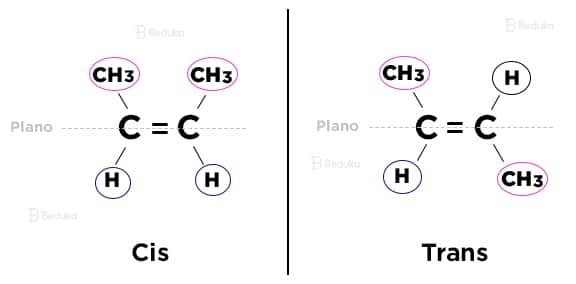
Desses 2 compostos formados, um é cis e o outro é trans.
- Cis: os ligantes iguais entre os carbonos ocupam o mesmo plano (superior ou inferior).
- Trans: os ligantes iguais entre os carbonos ocupam planos inversos, eles estão opostos, em diagonal.
Exemplo
- São mais de 200 resumos gratuitos no Instagram do Beduka. Aproveite!
Estereoisomeria em cadeia fechada
Como foi dito anteriormente, a isomeria geométrica só ocorre em cadeias fechadas, ou seja, as que são cíclicas sem ligações duplas entre os carbonos analisados.
Além disso, também é preciso que os ligantes de um mesmo C sejam diferentes e que os dois carbonos tenham pelo menos um ligante em comum entre si.
Importante:
Os compostos cíclicos são aqueles que formam um círculo ou anel. Então, a ligação dupla não é necessária, pois o próprio ciclo impede o movimento de rotação dos átomos de carbono e deixa livre somente os ligantes.
Desses 2 compostos formados, também temos que um é cis e o outro é trans.
Exemplo:

Qual a diferença entre Cis e Trans, E e Z?
O termo “Cis” veio do latim e significa “próximo a, lado a lado”. Já o termo “Trans” significa “através de”.
Também há uma outra etimologia: “Z” do alemão (zusammen) significa “juntos”. Já o “E” (entegegen) significa “opostos”.
Portanto:
- Cis pode ser dito como Z
- Trans pode ser dito como E
Você deve estar se perguntando: mas porque essa diferença?
A questão toda é que existe um órgão chamado IUPAC. Ela é a União Internacional de química pura e aplicada, uma espécie de órgão que controla todas as medidas químicas do mundo.
É isso mesmo, ela dita as regras de padronização e nós obedecemos. Antigamente nós conhecíamos a isomeria geométrica como Cis e Trans, mas a IUPAC recomenda a padronização como Z e E.
Portanto, você pode encontrar nas duas formas, dependendo do professor que fez a prova ou da data da questão. Por isso, é preciso guardar esse detalhe!
Há, ainda, quem diga que:
- A nomenclatura “Cis-trans” é usada quando os 2 ligantes de cada carbono são inguais entre si.
- Nomenclatura “Z-E” é usada quando temos os ligantes de cada carbono diferentes entre si.
Mas se é diferente, como saber o que é Z e o que é E?
Calma! Vamos explicar:
Ligantes de cada carbono diferentes entre si
O Isômero Z (ou Cis) será aquele que tiver os ligantes mais complexos ou de maior número atômico no mesmo plano.
O Isômero E (ou Trans) será aquele que tiver os ligantes mais complexos ou de maior número atômico em planos opostos.
Exemplo
Imagine uma cadeia fechada igual àquela que vimos no exemplo acima. Você viu que ambos carbonos de referência tinham ligantes H e CH3.
Agora, para ficar diferente, vamos supor que o primeiro carbono se liga a um H e um F. O segundo carbono se liga a um H e um Cl.
Ao consultar a tabela periódica, temos que o número atômico do CL é 17, o do F é 9 e o do H é 1.
Por isso, o Z (Cis) será aquele em que Cl e F estiverem em um mesmo plano. Já o E (Trans) será aquele em que esses elementos estiverem em planos opostos.
Atenção:
Nesse exemplo fica fácil de imaginar, pois os H também obedecem à regra. Por incrível que pareça, nem sempre é assim.
Pode acontecer de termos diferentes tamanhos de cadeias carbônicas ligadas aos carbonos de referência (no lugar do F e do Cl). Nesses casos, precisamos dar preferência a elas para saber o que é Z ou E, mesmo que os H fiquem opostos no Cis ou alinhados no Trans.
Onde a isomeria geométrica é aplicada? (Propriedades diferentes do Cis e Trans)
Sim, os isômeros geométricos possuem diferentes propriedades químicas e físicas, mesmo que sejam feitos dos mesmos elementos.
Ter um formato ou estrutura espacial diferente faz com que os diastereoisômeros tenham diferentes pontos de fusão e ebulição, densidade e solubilidade.
Além disso, as moléculas trans são mais estáveis que as cis e originam moléculas apolares. Isso acontece porque os grupos iguais estarem opostos faz com que as forças se anulem e não formem polos.
Por causa das diferentes propriedades física e químicas das moléculas cis e trans, a isomeria geométrica é aplicada na indústria química, farmacêutica e em demais experimentos científicos. Graças a ela, muitos medicamentos são seguros para nós.
Exemplo
Vamos conhecer os estereoisômeros cis-trans: ácido maleico e ácido fumárico.
- O ácido maleico é o isômero cis porque os dois grupos hidroxila (OH) estão no mesmo plano. Por causa dessa configuração menos estável, esse ácido sofre desidratação intramolecular e é tóxico.
- Já o ácido fumárico é o isômero trans porque possui os dois grupos hidroxila (OH) em planos opostos. Por causa da estabilidade vinda da anulação de forças, não interage, não sofre desidratação e não é tóxico.
Inclusive, o fumárico já existe naturalmente no corpo humano e é usado em tratamentos de pele contra a acne. Além disso, ele também está presente na planta fumária (Fumaria officinalis).
Quando NÃO ocorre Isomeria Geométrica?
Agora que você já sabe tudo desse assunto, não custa nada deixar claro as situações em que ela não ocorre, mas podem te confundir por falta de atenção ou esquecimento. São elas:
- Não ocorre em cadeias abertas saturadas (somente ligações simples entre carbonos). Pois podem sofrer rotações múltiplas e se alinharem igualmente
- Não ocorre em compostos que possuem ligações triplas entre os carbonos. Isso acontece porque só restará uma única ligação para os carbono envolvidos, então não haverá dois ligantes para compararmos.
- Não ocorre em grupos ligantes iguais, de um mesmo carbono. Pois ainda que rotacionem, será o mesmo elemento então fará diferença.
- Não ocorre se todos os ligantes de todos os carbonos forem diferentes entre si. Ou seja, não haverá nem mesmo um ligante em comum entre o carbono 1 e no 2.
Gostou do nosso artigo sobre Isomeria Geométrica? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





