O químico francês Antoine Lavoisier disse que em uma reação química os átomos não são criados nem destruídos, apenas rearranjados. Esse rearranjo é o que chamamos de balanceamento. Leia nosso resumo e treine com os 9 melhores exercícios sobre Balanceamento de Equações Químicas, com gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- Como balancear uma equação química?
- Quais são os 2 principais métodos de Balanceamento?
- Como é o balanceamento por Tentativa?
- Como é o balanceamento por Oxirredução?
- Exercícios sobre Balanceamento de Equações Químicas!
- Gabarito dos exercícios de Balanceamento de Equações Químicas
- Nós conectamos você à faculdade!
Quando você terminar os exercícios sobre Balanceamento de Equações Químicas, coloque em prática todo seu conhecimento com o Simulado Enem do Beduka. É 100% gratuito!
Como balancear uma equação química?
Balancear uma equação química se trata apenas de respeitar a lei da conservação de massa ou Lei de Lavoisier.
Essa lei diz que o número de mols dos reagentes deve ser o mesmo dos produtos. Ou seja, balancear uma equação significa deixar tudo equilibrado.
- São mais de 200 resumos no Instagram do Beduka!
Quais são os 2 principais métodos de Balanceamento?
Existem dois métodos principais de balanceamento cobrados em provas:
- Balanceamento por Tentativa.
- Balanceamento por Oxirredução.
Ainda teria um terceiro método chamado Balanceamento pelo método algébrico. Mas não vamos falar sobre ele, porque os outros dois são mais do que suficientes para uma prova ou vestibular de química.
Balanceamento por tentativa
Nesse método você simplesmente escolhe o que você vai balancear primeiro na equação de forma aleatória. Porém é sempre melhor seguir a lei do M.A.C.H.O, que nos indica a ordem de prioridade para começar:
- Metais (de acordo com a tabela periódica);
- Ametais (de acordo com a tabela periódica);
- Carbonos;
- Hidrogênios;
- Oxigênios.
Exemplo
Balanceie a equação:
Na2CO3 + HCl → NaCl + H2O + CO2
Seguindo a lei do macho, temos:
1. Balancear o Metal = Sódio (Na)
Tem 2 átomos de sódio no reagente. Então, para igualar, nós dobramos o NaCl do produto. Como resultado, teremos 2 NaCl (o Cl também foi dobrado!).
2. Balancear o ametal = Cloro (Cl)
Tem apenas um átomo de cloro no reagente. Porém, graças ao passo 1, agora tem 2 átomos de cloro no produto. Então, temos que dobrar o HCl no reagente para igualar.
3. Balancear o Carbono (C)
O carbono não precisa ser mexido por enquanto, já que tem um átomo de carbono de cada lado da equação.
4. Balancear o Hidrogênio (H)
Graças ao passo 2, agora tem dois átomos de hidrogênio de cada lado da equação. Então, ele também já está balanceado.
5. Balancear o oxigênio (O)
Há 3 átomos de oxigênio no produto e no reagente, portanto, ele também está balanceado.
- Como todos os elementos da equação já estão devidamente proporcionais, então a equação está balanceada! Ela ficará assim ao final:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Balanceamento por oxirredução
Este método é mais complexo, então preste bastante atenção para conseguir fazer os exercícios sobre balanceamento de equações químicas!
Inclusive, nós já fizemos um texto explicando tudo sobre a Oxirredução em Pilhas!
Antes de mostrar o método, vamos relembrar os conceitos que usaremos:
O que é a reação de oxirredução?
As reações químicas são um conjunto de ações entre duas ou mais substâncias.
Os Reagentes são as substâncias que sofrem as mudanças (estão no primeiro membro, à esquerda). Os Produtos são as substâncias formadas (aparecem no segundo membro, à direita).
Como estamos falando em oxirredução, envolvemos os íons. Então a equação de oxirredução é representada assim:
- Oxidação: o elemento (X) perde elétron (e–) e se transforma em um cátion (X+).
- Redução: o elemento (Y) ganha elétron (e–) e se transforma em um ânion (Y–).
O que é NOX e eletronegatividade?
NOX (número de oxidação) é o número pequenininho que fica acima do elemento, mostrando se ele perdeu ou ganhou elétrons e a quantidade.
Eletronegatividade é a tendência de um elemento a ganhar elétrons.Isso ocorre até atingir o equilíbrio (regra do octeto: 8 elétrons na última camada).
Com base na eletronegatividade, sabemos que os nox dos elementos serão:
- Hidrogênio (H): O NOX do hidrogênio sempre será +1.
- Oxigênio (O): O NOX do oxigênio na maioria das vezes será -2.
- Metais alcalinos (Família (coluna) 1A da tabela periódica): Todos os elementos dessa coluna tem NOX +1 quando encontrados em substâncias compostas (formadas por mais de um elemento)
- Metais alcalino terrosos (Família (coluna) 2A da tabela periódica): Todos os elementos dessa coluna tem NOX +2 quando encontrados em substâncias compostas (formadas por mais de um elemento)
- Halogênios (Família (coluna) 7A da tabela periódica): Todos os elementos dessa coluna tem NOX -1 quando são o mais eletronegativo da ligação (e normalmente eles são).
Normalmente o NOX já vem escrito na questão. Mas se não vier, lembre-se dessas regras:
- O NOX de substâncias simples (N2 por exemplo) é zero!
- Íons formados de um único átomo tem o NOX igual a carga desse átomo.
- Substâncias compostas tem o NOX sempre zerado pela soma dos NOX de cada elemento formador.
- íons compostos sempre tem uma carga que é o resultado da soma dos NOX de cada elemento que o forma.
Voltando ao Balanceamento por Oxirredução
O Balanceamento por Oxirredução é como se fossem dois balanceamentos em um. Agora, você não vai balancear só as massas dos átomos, mas também as cargas deles.
Exemplo
Balanceie a equação:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
1. Determine o NOX de cada elemento
Potássio (K) é um metal alcalino, por tanto sua carga é +1.
Oxigênio (O) normalmente tem carga -2, mas são 4 átomos de oxigênio, então sua carga total é -8
Manganês (Mn) a carga tem que ser suficiente para zerar o NOX de toda a substância composta. E como – 8 + 1 = – 7 a carga de Mn é o oposto disso, ou seja, +7.
No HCl, a carga do hidrogênio normalmente é +1 e a do cloro normalmente é -1, porque ele é um halogênio. Mas você nem precisa se lembrar disso se você lembrar de que as cargas têm que se anular. Logo + 1 – 1 = 0.
O mesmo vale para o KCl (metal alcalino de carga +1 com halogênio de carga -1 = 0).
Para o (MnCl2), se você não sabe o NOX do Mn é só lembrar que o do Cl é -1 porque ele é um halogênio. Aí você multiplica por 2, já que são 2 átomos de Cl. A carga do Mn tem que ser o bastante para dar 0, logo, é +2.
O (Cl2) já é uma substância simples então o seu NOX já é zero automaticamente.
Para a molécula de água, é só aplicar a mesma lógica já explicada.
Ao final, teremos que o nox individual de cada elemento é:
K+1Mn+7O4-8 + H+1Cl-1 → K+1Cl-1 + Mn+2Cl2-2+ Cl20+ H2+2O-2
2. Determine a variação do NOX
É mais fácil do que o nome faz parecer. Veja: no reagente, a carga do Mn era +7 e no produto +2. A carga diminuiu, então ele sofreu redução.
Se alguém reduziu, então um outro alguém tem que oxidar. Nesse caso, foi o Cl. Perceba que no reagente sua carga era -1 e no produto é 0. Ou seja, nessa reação, Mn ganhou 5 elétrons e o Cl perdeu um elétron.
Para calcular a variação do NOX, nós multiplicamos a variação de elétrons (5 para o Mn e 1 para o Cl) pela maior atomicidade dos elementos em questão (o máximo de átomos de Mn na reação por substância foi 1 e no caso do Cl foram 2).
Sendo assim, temos os resultados das variações:
KMnO4: ∆Nox = 5 . 1 = 5
Cl2: ∆Nox = 1 . 2 = 2
3. Inverta os valores obtidos no passo dois
Em uma reação de oxirredução os elétrons também são rearranjados, por tanto, é a inversão de valores que dará a proporção. Ou seja, 5 será o coeficiente do (Cl2) e 2 será o do (KMnO4).
A equação ficará assim:
2 KMnO4 + HCl → KCl + MnCl2 + 5 Cl2 + H2O
4. Faça o balanceamento por tentativa da equação acima
Eu sei. Você deve estar querendo nos matar agora. Mas, em minha defesa, avisamos que eram dois balanceamentos em um…
- Quer saber como fazer balanceamento químico com mais dicas e exemplos? Veja nosso resumo completo sobre o assunto!
Agora que você entendeu tudo sobre como fazer balanceamento químico, responda as 09 melhores questões sobre balanceamento de equações químicas!
Exercícios sobre Balanceamento de Equações Químicas
Questão 1 – (UFPE)
Considere as reações químicas abaixo.
1. 2K(s) + Cl2(g) → KCl(s)
2. 2Mg(s) + O2(g) → 2MgO(s)
3. PbSO4(aq) + Na2S(aq) → PbS(s) + Na2SO4(s)
4. CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
5. SO2(g) + H2O(l) → H2SO4(aq)
Podemos afirmar que:
a) todas estão balanceadas.
b) 2, 3 e 4 estão balanceadas.
c) somente 2 e 4 estão balanceadas.
d) somente 1 não está balanceada.
e) nenhuma está corretamente balanceada, porque os estados físicos dos reagentes e produtos são diferentes.
Questão 2 – (Mackenzie-SP)
Aquecido a 800 °C, o carbonato de cálcio decompõe-se em óxido de cálcio (cal virgem) e gás carbônico. A equação corretamente balanceada, que corresponde ao fenômeno descrito, é:
(Dado: Ca = metal alcalino-terroso)
a) CaCO3 → 3CaO + CO2.
b) CaC2 → CaO2 + CO.
c) CaCO3 → CaO + CO2.
d) CaCO3 → CaO + O2.
e) CaCO3 → Ca + C + O3.
- Estamos apenas no começo dos exercícios sobre balanceamento de equações químicas. Concentre-se e dê o seu melhor!
Questão 3 – (UFMG)
A equação Ca(OH)2 + H3PO4 → Ca3(PO4)2 + H2O não está balanceada. Balanceando-a com os menores números possíveis, a soma dos coeficientes estequiométricos será:
a) 4.
b) 7.
c) 10.
d) 11.
e) 12.
Questão 4 – (ENEM)
Os calcários são materiais compostos por carbonato de cálcio, que podem atuar como solventes do dióxido de enxofre (SO2), um importante poluente atmosférico. As reações envolvidas no processo são a ativação do calcário, por meio da calcinação, e a fixação de SO2 com a formação de um sal de cálcio, como ilustrado pelas equações químicas simplificadas.
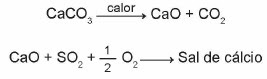
Considerando-se as reações envolvidas nesse processo de dessulfurização, a fórmula química do sal de cálcio corresponde a:
a) CaSO3.
b) CaSO4.
c) CaS2O8.
d) CaSO2.
e) CaS2O7.
Questão 5 – (ENEM)
As mobilizações para promover um planeta melhor para as futuras gerações são cada vez frequentes. A maior parte dos meios de transporte de massa é atualmente movida pela queima de um combustível fóssil. A título de exemplificação do ônus causado por essa prática, basta saber que um carro produz, em média, cerca de 200g de dióxido de carbono por km percorrido.
Revista Aquecimento Global. Ano 2, no 8. Publicação do Instituto Brasileiro de Cultura Ltda.
Um dos principais constituintes da gasolina é o octano (C8H18). Por meio da combustão do octano é possível a liberação de energia, permitindo que o carro entre em movimento. A equação que representa a reação química desse processo demonstra que:
a) no processo há liberação de oxigênio, sob a forma de O2.
b) o coeficiente estequiométrico para a água é de 8 para 1 do octano.
c) no processo há consumo de água, para que haja liberação de energia.
d) o coeficiente estequiométrico para o oxigênio é de 12,5 para 1 do octano.
e) o coeficiente estequiométrico para o gás carbônico é de 9 para 1 do octano.
- Muito bem! Você chegou na metade dos exercícios sobre balanceamento de equações químicas.
Questão 6 – (UFRN)
A pureza das águas subterrâneas de Natal (RN) se encontra ameaçada pela insuficiência do sistema de saneamento urbano, uma vez que a construção de fossas sépticas contribui para a poluição dos poços artesianos. Os principais contaminantes são os nitratos (NO3-) e nitritos (NO2-), que se infiltram nos lençóis freáticos. A professora Ruth, após a discussão sobre esse tema, demonstrou uma reação de oxirredução que permite identificar a poluição pelo íon nitrito (NO2-). Em solução aquosa acidulada, esse íon reage com a uréia, liberando nitrogênio e gás carbônico, segundo a equação (não-balanceada) abaixo:
NO2- H+ CO(NH2)2 → N2 + CO2 + H2O
Nessa reação, os coeficientes estequiométricos para o balanceamento dos produtos da equação são, respectivamente:
a) 1, 2 e 3.
b) 1, 3 e 2.
c) 2, 1 e 3.
d) 3, 1 e 2.
Questão 7 – (CFTMG)
Sais de ferro podem ser oxidados por vários oxidantes. Uma dessas reações pode ser representada por essa equação não balanceada
FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + H2O
A soma dos menores coeficientes inteiros que acertam essa equação é
a) 7.
b) 8.
c) 10.
d) 13.
- Calma, a lista de exercícios sobre balanceamento de equações químicas está chegando ao fim. Vamos com tudo para os dois últimos exercícios!
Questão 8 – (UFLA)
Uma importante rota de determinação de ferro é a titulação que utiliza permanganato de potássio em meio ácido. A equação não-balanceada da reação química envolvida é
MnO4– Fe2+ H+ → Mn2+ Fe3+ H2O
A soma dos coeficientes apenas no lado dos produtos, após o balanceamento, é
a) 23.
b) 14.
c) 10.
d) 3.
Questão 9 – (Mackenzie)
A equação corretamente balanceada é:
a) 2 Fe + O2 → Fe2O3
b) 2 Fe + 3O2 → 2 Fe2O3
c) 4 Fe + O2 → Fe2O3
d) Fe + 3 O2 → Fe2O3
e) 4 Fe + 3 O2 → 2 Fe2O3
- Parabéns, você fez todos os exercícios de Balanceamento de Equações Químicas!
Gabarito dos exercícios sobre Balanceamento de Equações Químicas
Exercício resolvido da questão 1 –
b) 2, 3 e 4 estão balanceadas.
Exercício resolvido da questão 2 –
c) CaCO3 → CaO + CO2.
Exercício resolvido da questão 3 –
e) 12.
Exercício resolvido da questão 4 –
b) CaSO4.
Exercício resolvido da questão 5 –
d) o coeficiente estequiométrico para o oxigênio é de 12,5 para 1 do octano.
Exercício resolvido da questão 6 –
c) 2, 1 e 3.
Exercício resolvido da questão 7 –
a) 7.
Exercício resolvido da questão 8 –
c) 10.
Exercício resolvido da questão 9 –
e) 4 Fe + 3 O2 → 2 Fe2O3
Esperamos ter ajudado você com nossa seleção dos melhores exercícios sobre balanceamento de equações químicas.
A seguir temos uma oportunidade incrível que pode mudar sua vida, não deixe de conferir!
Nós conectamos você à faculdade!
Você sabia que é possível entrar em uma excelente universidade, no curso dos seus sonhos, sem fazer o Enem ou vestibular?
É isso mesmo! Estamos falando do Beduka Bolsas.
O Beduka Bolsas é uma plataforma online que te conecta com bolsas de estudos nas melhores universidades!
São mais de 90 opções de cursos para você escolher, com bolsas que podem chegar até 65% de desconto no valor da mensalidade, e de quebra, você ainda ganha a matrícula gratuita!
Você não pode perder essa oportunidade. Acesse o Beduka Bolsas agora e saiba mais!
Gostou dos nossos exercícios sobre Balanceamento de Equações Químicas? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira!
Siga nosso Instagram e Pinterest para receber conteúdos e resumos de matérias que caem no Enem e outros vestibulares diariamente e dê um up nos seus estudos!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, mensalidade e muito mais.
Experimente agora!






4 Comentários
A resposta do exercício 5 é letra d
Muito bom, Victor. Consertamos!
eu acho que a resposta da questão 3 seria 11
Anna, você deve estar considerado o valor à frente do Ca3(PO4)2 como nulo, mas há o 1 aí. Então a soma da 12 mesmo.