A Pilha é um dispositivo que produz corrente elétrica a partir da energia química. É com uma reação de oxidorredução que isso é possível, pois um dos reagentes perde elétrons (oxida) e outro ganha (reduz). Para entender mesmo o que é pilha, você ainda precisa saber dos tipos, das equações e de como realizar os cálculos!
Neste artigo sobre o que é pilha, você encontrará:
- O que é pilha e como funciona
- Componentes da pilha e representação das reações
- Tipos e exemplos de pilhas químicas: Volta, Daniell, Leclanté e Alcalina
- Equação global
- Cálculo de ddp
- Estudando para as provas? Conheça O melhor Simulado do Brasil! Ele pode ser personalizado com as matérias que você mais precisa!
O que é pilha e como funciona? (Conceito)
A Pilha é um dispositivo em que acontece a produção de corrente elétrica a partir da energia química. É por meio de uma reação de oxidorredução que conseguimos fazer isso, na qual um dos reagentes perde elétrons (oxida) e outro ganha elétrons (reduz).
Não entendeu nada? Calma que vamos explicar com detalhes mais para frente. Apenas lembre-se que a pilha também pode ser chamada de célula galvânica e que o movimento de elétrons é que produz a corrente.
Elas receberam esse nome porque a primeira pilha a ser criada era formada por discos de zinco e cobre empilhados de forma intercalada, formando uma grande coluna. O inventor foi Alessandro Volta, em 1800. Veremos mais detalhes adiante!
Nas pilhas, a oxirredução ocorre de forma espontânea, por isso é bem eficiente. O sistema fornece energia até que a reação química se esgote e é aí que dizemos “a pilha acabou”.
Representação das reações de oxirredução
As reações químicas são um conjunto de ações que acontecem entre duas ou mais substâncias. Elas formam diferentes compostos químicos e podemos representar isso com uma equação.
Os Reagentes são as substâncias que sofrem as mudanças e aparecem no primeiro membro da equação (lado esquerdo). Os Produtos são as substâncias formadas e aparecem no segundo membro (lado direito).
Como estamos falando em pilha e oxirredução, podemos representar assim:
- Oxidação: o elemento (X) perde elétron (e-), então se transforma em um cátion (X+).
X → X+ + e-
- Redução: o elemento (Y) ganha elétron (e-), então se transforma em um ânion (Y-).
Y + e- → Y-
Como é feita a pilha? Componentes básicos e funcionamento
As pilhas são sempre formadas por dois eletrodos (placas) e um eletrólito (solução):
- Ânodo: é o eletrodo negativo, onde ocorre a reação de oxidação (perda de elétron).
- Cátodo:é o eletrodo positivo, onde ocorre a reação de redução (ganho de elétron).
- Eletrólito: também chamado de ponte salina, é uma solução eletrolítica, ou seja, um meio aquoso capaz de conduzir íons. Por aí que os elétrons cedidos pelo ânodo chegarão até o cátodo.
O funcionamento de uma pilha ocorre a partir dos seguintes princípios:
- 1º Princípio – Oxidação no ânodo: o metal que está no ânodo, por apresentar maior tendência de perder elétrons, transforma-se em um cátion:
Zn → Zn2+ + 2 e-
- 2º Princípio – Redução no cátodo: os cátions que fazem parte do material do cátodo (usamos o cobre como exemplo), recebem os elétrons que vieram do ânodo e transformam-se em cobre metálico:
Cu2+ + 2e- → Cu
Qual o sentido dos elétrons em uma pilha?
Já sabemos que a corrente elétrica é formada pela movimentação dos elétrons, portanto, o sentido da corrente é o mesmo sentido dos elétrons. Eles sempre vão no sentido do ânodo para o cátodo.
Se levarmos em conta que oxidação e redução são processo inversos e que “ter potencial” é “tender a algo”, podemos dizer que:
- O sentido dos elétrons vai do eletrodo com menor potencial de redução (ânodo oxida) para o eletrodo com maior potencial de redução (cátodo reduz).
É equivalente a:
- Vai do eletrodo com maior potencial de oxidação (ânodo oxida) para o eletrodo com menor potencial de oxidação (cátodo reduz).
Exemplos e tipos de pilha química
As primeiras pilhas inventadas, como dissemos lá no início do texto, precisavam de toda uma estrutura e aparelhos dignos de laboratório! As reações estavam sendo testadas e era preciso ter fácil acesso as partes da pilha para modificá-las.
Alessandro Volta criou a primeira delas e logo depois Daniell aperfeiçoou fazendo gerar mais energia! Essas pilhas recebem o nome de seus criadores.
Atualmente existem vários modelos de pilhas, mas os mais utilizados são pilha de Leclanché e a pilha alcalina.
As pilhas atuais possuem esse mesmo princípio de funcionamento. A diferença é que elas são secas, ou seja, não utilizam uma solução líquida como eletrólito.
Vamos conhecer cada um dos tipos de pilhas químicas:
Pilha de Alessandro Volta
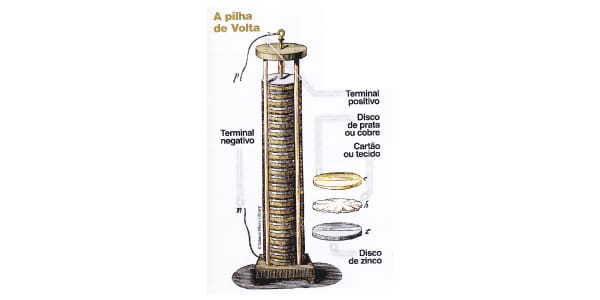
A pilha de Alessandro volta foi a primeira pilha da história! O químico a montou no ano de 1800 e ela era formada por discos de metais intercalados, como na imagem acima!
Volta notou que esses metais com diferentes potenciais elétricos faziam a corrente passar de um para o outro. Pensando em aumentar esse fluxo, criou uma sequência para ver se “acumulava e impulsionava” a energia.
Por isso, ele formou uma torre (coluna, pilha) de discos de zinco e cobre. Ele também já sabia que os meios aquosos com íons conduziam bem a eletricidade, então recheou a estrutura com algodões embebidos em salmoura (solução de água com sal).
Pilha de Daniell
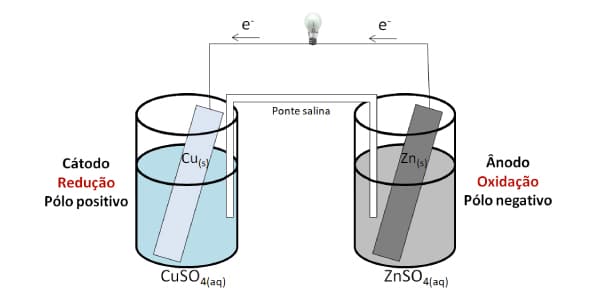
Em 1836, Daniell estudava a pilha de Volta e tentou aperfeiçoá-la para gerar uma voltagem maior (unidade de energia, corrente elétrica). Então, ele criou uma estrutura como a da imagem acima.
Não se assuste, vamos entender como ela funciona e o que é cada um desses elementos!
A pilha de Daniell é composta por duas semicelas (recipientes) ligadas por um fio condutor e uma ponte salina.
- Semicela 1: é o ânodo, ou seja, o eletrodo ou polo negativo. Para isso, utilizamos uma placa de zinco (menor potencial de redução e maior potencial de oxidação), sendo que uma parte dessa placa ficava submersa na solução de água e sulfato de zinco (ZnSO4).
- Semicela 2: é o cátodo, ou seja, o eletrodo ou polo positivo. Para isso, utilizamos uma placa de cobre (maior potencial de redução e menor potencial de oxidação), sendo que uma parte dessa placa fica submersa na solução de água e sulfato de cobre (CuSO4).
- Ponte salina: é o tubo de vidro em formato de “U”, com um pedaço de lã nas extremidades. O seu interior é formado por uma solução de água e cloreto de potássio (KCl), conectando as duas semicelas (zinco e cobre).
- Fio condutor: por fim, havia um fio condutor que ligava as duas placas a uma lâmpada no meio. Sua função é transportar a corrente elétrica produzida para ver se acende a lâmpada!
O que acontece é que o zinco tem menor potencial de redução (tende a oxidar, perder elétrons). Por isso, o zinco metálico da lâmina funciona como o eletrodo negativo (ânodo) e vai se corroendo, justamente porque perde componentes:
Zn(s) ↔ Zn2+(aq) + 2 e-
Os elétrons perdidos pelo zinco são transportados até o cobre, gerando a corrente elétrica que acende a lâmpada.
Os íons cobre da solução recebem os elétrons, reduzindo-se Assim, eles se transformam em cobre metálico e se deposita sobre a lâmina de cobre. Isso significa que esse é o eletrodo positivo (cátodo):
Cu2+(aq) + 2 e- ↔ Cu(s)
Pilha de Leclanché
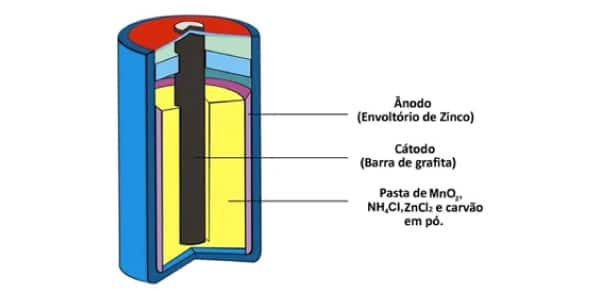
Esse modelo de pilha já é um dos mais atuais. Elas são mais indicadas para equipamentos com descargas leves e contínuas.
Exemplo: controle remoto, relógio de parede, rádio portátil e brinquedos.
Essa pilha possui um ânodo formado por zinco metálico, enquanto o polo positivo é uma barra de grafita instalada no meio da pilha.
Tudo isso está envolvido por uma pasta úmida, dióxido de manganês (MnO2) e carvão em pó (C). A pasta é formada de cloreto de amônio (NH4Cl), cloreto de zinco (ZnCl2) e água (H2O). Esses sais têm um ph ácido.
Pilha alcalina

Esse modelo de pilha é o mais atual e também mais utilizado, comum. Elas são mais indicadas para equipamentos que exigem descargas rápidas e intensas, já que possuem de 50 a 100% a mais de energia que uma pilha comum.
Exemplo: rádios, tocadores de CD/DVD, MP3 portáteis, lanternas e câmeras fotográficas digitais.
Existem variações de materiais que podem formar essas pilhas e vão diferenciar na voltagem gerada. Mas, todas elas tem sais com um ph básico (alcalino).
Veja algumas possibilidades:
- Pilha alcalina comum: 1.5 V (a mais comum)
Ânodo de zinco ou cádmio.
Cátodo de mistura pastosa com cloreto de potássio (Kcl) em vez do de amônio.
- Pilha de mercúrio e zinco: 1,35 V (relógios e calculadoras antigas)
Ânodo de zinco.
Cátodo de pasta com óxido de mercúrio (HgO).
- Pilha alcalina de lítio e iodo: 2,8 V (costuma ser usada em marca-passo)
Ânodo com placa de lítio.
Cátodo com um complexo de iodo.
Como encontrar a equação global da pilha?
Nem sempre os vestibulares cobram apenas a parte teórica, mas também os cálculos dos potenciais e das reações. Vamos entender o que é isso e como fazer:
Semirreação é quando escrevemos apenas uma parte de uma reação global. Ao longo do texto acima, nós escrevemos várias delas, como:
Zn → Zn2+ + 2 e-
e
Cu2+ + 2e- → Cu
Porém, o processo inteiro, do início ao fim, pode ser representado por uma única reação global. Para chegar a ela, precisamos apenas somar as semirreações:
Zn → Zn2+ + 2 e-
+ Cu2+ + 2e- → Cu
Equação global: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
É importante que o número de elétrons entre as semirreações seja o mesmo. Assim, eles não aparecerão na reação final (o mesmo número em lados opostos se anulam) e isso demonstra que o processo ocorreu completamente.
No exemplo, eles já estão iguais, então bastou somar. Caso não estejam, você deve encontrar um número adequado para multiplicar uma ou ambas as semirreações (ela inteira) e chegar a um número igual de elétrons.
Exemplo: se a primeira semirreação tivesse 3e- e segunda tivesse 2e-, sabendo que o MMC entre 3 e 2 é 6, multiplicaríamos a primeira pelo fator 2x e a segunda pelo 3x. Ao final, ambas teriam 6 e- e poderíamos encontrar a reação global.
Lembre-se que multiplicamos a equação inteira, portanto o índice numérico da quantidade de elétrons muda e o da quantidade do elemento (zinco, cobre) muda também!
O que é dpp (diferença de potencial)?
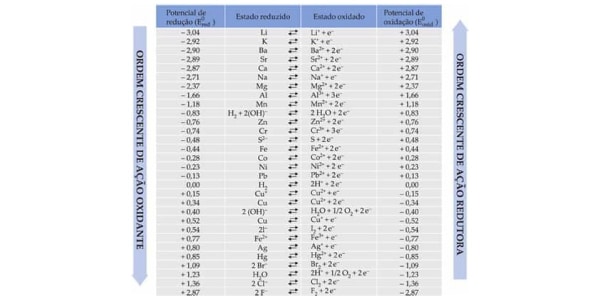
No universo das pilhas, o potencial é um número que representa o quão grande é a tendência de perder ou ganhar elétrons daquela substância.
- Se analisarmos sua tendência a ganhar elétrons, estamos falando do potencial padrão de redução (E°Red).
- Se analisarmos sua tendência a perder elétrons, estamos falando do potencial padrão de oxidação (E°Oxi).
A dpp significa diferença de potencial e é simplesmente o valor que obtemos depois de subtrair determinados potenciais.
Isso é útil porque esse valor representa a voltagem da corrente elétrica que aquela pilha terá, dependendo dos componentes que a formam. Também podemos chamar a ddp de força eletromotriz (sigla é fem) ou de variação do potencial (símbolo é ΔE).
Exemplo:
Já vimos que o cobre possui maior tendência a reduzir, logo, seu E°Red é numericamente maior que o do zinco. Se estivermos olhando a tabela de E°Oxi, o número do zinco será maior e o do cobre será menor.
- Fique tranquilo porque esses valores costumam vir escritos na questão ou te darão uma tabela. Sempre confira se os potenciais escritos alí são de redução ou de oxidação!
Como calcular a ddp?
A tensão elétrica gerada quando os elétrons se deslocam e geram corrente é indicada sempre pela unidade Volts (símbolo V). Com o cálculo da dpp descobrimos esse valor.
Para calcular a ddp de uma pilha, é necessário já saber os potenciais de redução ou de oxidação de cada um dos eletrodos.
Depois disso, basta subtrair o menor do maior, assim:
ΔE = E°Red maior – E°Red menor
ou
ΔE = E°Oxi maior – E°Oxi menor
Atenção!
Saiba que os potenciais de um mesmo elemento, seja de redução ou oxidação, possuem o mesmo valor numérico.
A diferença é que o de oxidação tem um sinal negativo e o de redução tem um sinal positivo.
Portanto, se uma questão te der o E°Red de um e o E°Oxi de outro, basta inverter o sinal de apenas um deles!
Exemplo: Calcule quantos Volts uma pilha Cu | Cu2+ || Ag+ | Ag irá gerar, sabendo que E°red (Cu) = +0,34 V e E°Oxi (Ag) = -0,8 V.
Resolução: Não podemos sair simplesmente subtraindo tudo porque um potencial foi de redução e o outro de oxidação. Se optarmos por usar o E°Red, faremos:
E°red (Cu) = +0,34 V
E°Red (Ag) = +0,80 V (sinal contrário do E°Oxi)
Agora sim vemos que o Ag tem maior potencial que o Cu. Portanto, neste tipo de pilha o Ag reduz e o Cu oxida.
Fazendo as contas, obtemos que a dpp dessa pilha é:
ΔE = +0,80 (E° maior) – +0,34 (E° menor)
ΔE = 0,80 – 0,34
ΔE = 0,46 V
Gostou do nosso artigo sobre o que é pilha? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





