A Ligação iônica é a ligação química que ocorre entre um ametal e um metal. Neste tipo de ligação, o metal perde elétrons e o ametal ganha, portanto, há transferência de elétrons. A consequência é a formação de íons: cátions (elementos que perderam elétrons) e ânions (elementos que ganharam elétrons). Leia este resumo e entenda o que é ligação iônica!
Se você quiser ir diretamente para alguma parte do texto, clique em um dos tópicos abaixo:
- O que são ligações químicas?
- O que é ligação iônica?
- Exemplos de ligações iônicas
- Quais são as características da ligação iônica?
- Nós conectamos você à faculdade!
Estudando Química para o Enem? Depois de ler nosso resumo sobre o que é ligação iônica, teste seus conhecimentos com o Simulado Beduka do Enem. Ele é totalmente gratuito e personalizável, acesse agora!
O que são ligações químicas?
Você já deve ter ouvido falar que tudo o que conhecemos como matéria é formado por minúsculas partículas chamadas átomos. Além disso, cada elemento que conhecemos na tabela periódica corresponde a um tipo de átomo.
Esses átomos podem se unir para formar moléculas. As moléculas vão se unindo em grupos cada vez maiores até se tornarem as células de um ser vivo, por exemplo. Você já entendeu a lógica, mas deve estar se perguntando como esses átomos se unem.
São as ligações químicas ou moleculares que permitem essa junção. Como elas são químicas e não físicas, isso significa que há mudanças na natureza do átomo, ou seja, há reações.
Na realidade, há três tipos de ligações:
- Metálicas: acontecem entre dois metais
- Covalentes: acontece entre dois ametais
- Iônicas: acontece entre um ametal e um metal
Quer entender mais sobre quais são os tipos de ligações químicas? Leia nosso resumo completo sobre o assunto!
Neste artigo, vamos aprender tudo sobre a Ligação Iônica e suas características, vamos lá:
O que é Ligação Iônica?
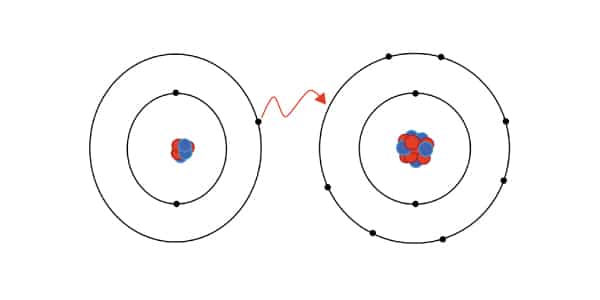
A Ligação iônica ocorre entre um ametal e um metal ou entre o hidrogênio e um metal. Essa interação atômica é caracterizada pelo metal perder um elétron que é transferido para o ametal. Portanto, nela há perda e ganho de elétrons por causa de uma transferência que busca o equilíbrio.
Não entendeu nada? Calma, vamos explicar:
Os metais são aqueles elementos da tabela periódica com características bem específicas, como refletir luz, conduzir eletricidade e aquilo que já sabemos do dia a dia. Os ametais são aqueles elementos que não são metais e também não são gases nobres.
Os gases nobres são elementos com características curiosas: eles não reagem com nenhum outro elemento. Eles são autossuficientes, já estão em equilíbrio. Na linguagem química, estar em equilíbrio é ser estável, ou seja, ter todas as forças harmonizadas dentro do átomo.
Quase todos os elementos que conhecemos só atingem estabilidade quando têm 8 elétrons na camada de valência, ficando com a mesma configuração eletrônica que a dos gases nobres. Essa é a Regra do Octeto, mas o hidrogênio é uma exceção: ele fica bem com 2.
- Mas o que é camada de valência?
Você já deve ter lido nosso artigo sobre átomos e sabe que eles têm a forma de um “sistema solar”. No meio ficam os prótons e ao redor, ficam elétrons. Cada “órbita” de elétrons é chamada de camada ou níveis eletrônicos e o átomo pode ter até 7 camadas (k,l,m,n,o,p,q).
Cada nível possui até quatro subdivisões internas chamadas de subníveis ou orbitais (s,p,d,f). É como uma pista de corrida dividida em faixas internas para cada corredor. Portanto, cada nível e subnível tem seus limites de números de elétrons.
Você estuda todas essas informações na matéria de distribuição eletrônica. O que é importante saber agora é que a valência é dada pelo número de elétrons na última camada de um átomo.
É importante saber dela porque ela está mais distante do núcleo. Assim, se aquele átomo tiver que perder ou ganhar algo, é nessa camada que as coisas mudarão.
Como a ligação iônica ocorre?
A ligação iônica ocorre por causa das forças eletrostáticas que atraem átomos com cargas opostas. Quanto maior a diferença de eletronegatividade, mais forte é a ligação.
Falei grego de novo? Vamos explicar:
- Os ametais da tabela possuem uma distribuição eletrônica cuja valência costuma ser de 4 a 7. Isso significa que é mais fácil eles ganharem elétrons para se tornarem estáveis do que se esvaziar. Quando um elemento ganha elétrons, ele fica mais negativo e é chamado de ânion.
- Já os metais costumam ter uma valência entre 1 e 4, então é menos trabalhoso eles perderem para ficar estáveis. Quando um elemento perde elétrons, ele fica mais positivo e é chamado de cátion.
É por esse motivo que as forças eletrostáticas (atração ou repulsão entre elétrons e prótons) agem de forma que o metal sempre cede o elétron que será recebido pelo ametal.
Assim, concluímos que a ligação iônica é um tipo de ligação química que ocorre com a interação eletrostática entre elementos de cargas opostas, formando cátions e ânions.
- Atenção!
Podem existir ametais com valência menores que 4, como o Oxigênio que vale 2. Na explicação acima, colocamos apenas uma generalização para ficar mais fácil de enxergar. Nesses casos ainda é possível haver ligações iônicas, mas envolverá mais de um átomo de cada elemento. Colocamos um exemplo adiante!
Qual é o resultado de uma ligação iônica?
O resultado de uma ligação iônica é, como o próprio nome diz, a formação de íons (cátions e ânions)! Os íons nada mais são que elementos que perderam ou ganharam elétrons, ou seja, saíram da sua configuração inicial e apresentam uma nova carga.
Outro resultado que só é possível nesse tipo de ligação é a formação de redes cristalinas ou retículos cristalinos. Isso acontece porque vários íons são formados ao mesmo tempo e todos se atraem. Para não haver caos ou repelência, os íons se organizam em estruturas geométricas.
Por isso é que o sal tem a forma de pequenos cristais! Vamos entender como ele se isso acontece:
Exemplos de ligação Iônica e Fórmula de Lewis
Vamos analisar a formação do sal (cloreto de sódio) e do óxido de alumínio, moléculas compostas pela ligação iônica.
Iremos usar a fórmula de Lewis, uma maneira de representar elementos e reações com desenhos e símbolos que deixam explícitos os elétrons de valência em forma de bolinhas.
Ligação Iônica na formação do Cloreto de sódio
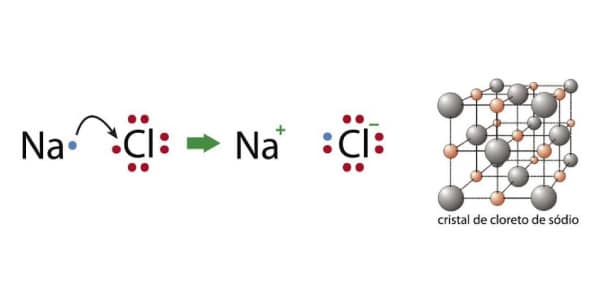
O Cloro (Cl) é um ametal que possui valência 7, enquanto o Sódio (Na) é um metal que possui valência 1.
Quando esses dois entrarem em contato, automaticamente verão a possibilidade de entrarem em equilíbrio (deu match).
Assim, a ligação iônica ocorrerá quando o sódio ceder o seu 1 elétron para o cloro. Ambos ficarão com 8 elétrons, mas o Sódio se tornará Na+1 e o Cloro será Cl-1.
- O símbolo “-1” não significa que o sódio perdeu um elétron, significa que ele ganhou um elétron. Lembre-se: elétrons são de natureza negativa, quando um elemento ganha, fica mais negativo.
- Da mesma forma, o símbolo“+1” não significa que o sódio ganhou um elétron, significa que ele perdeu um elétron. Lembre-se: um elemento fica mais positivo quando perde um elétron.
Você pode ver o íon escrito apenas como Na+Cl-, sem mostrar o número 1. Na realidade, só podemos fazer isso se o número for 1, porque o valor fica implícito.
Toda vez que houver um número maior do que 1, ele deverá ser escrito normalmente.
Ligação Iônica na formação do Óxido de alumínio
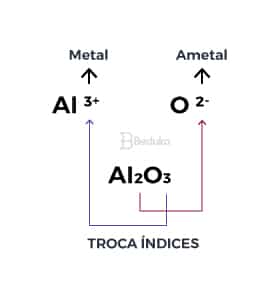
O Oxigênio (O) é um ametal que possui valência 6 então precisa de 2 elétrons para se estabilizar. Já o Alumínio (Al) é um metal que possui valência 3, então tenderá a perder esses 3 elétrons quando estiver próximo do oxigênio.
Porém, as valências não estão nítidas como no exemplo anterior. O que fazer? Precisaríamos calcular qual a quantidade de cada átomo para que tudo fique no mesmo “denominador comum”. Mas daria muito trabalho!
Nesses casos, basta aplicar o conceito de íon-fórmula! A fórmula de uma substância formada por ligação iônica é denominada íon-fórmula, isso é um padrão observado e comprovado, confia!
Ela é dada quando cruzamos as cargas do metal e do ametal. Depois, a carga de um transforma-se no índice atômico do outro, indicando qual a quantidade de átomos necessária para obter o equilíbrio e formar a ligação!
- Já sabemos que, independente da quantidade de átomos, os íons que se formarão ao final dessa ligação serão do tipo Al+3 e O-2, porque o alumínio perderá os seus 3 e o oxigênio precisa ganhar 2.
Agora, basta realizar a troca de índices para saber quanto de cada átomo precisaremos. Na imagem acima você consegue notar que precisaremos de 2 átomos de alumínio a cada 3 de oxigênio.
Não foi possível observar esse fenômeno na formação do sal porque os dois índices eram 1, então não faz diferença trocar.
Quais elementos da tabela periódica podem realizar ligações iônicas?
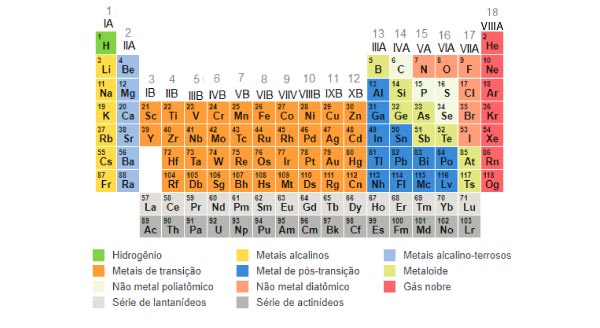
Qualquer elemento na tabela periódica que não seja um gás nobre pode realizar ligações iônicas, desde que sejam combinados com outros elementos corretos.
Isso significa que podemos pegar qualquer ametal com um metal, desde que estejam nas quantidades devidas.
Mas lembre-se alguns formam-se mais facilmente que outros por causa da grande diferença de eletronegatividade.
- Mas vamos te dar dicas:
Dos elementos que compõem a tabela periódica, os que apresentam tendência de perder elétrons são os metais das famílias IA (Metais Alcalinos), IIA (Metais Alcalino-Terrosos) e IIIA (família do Boro).
Por outro lado, os que possuem tendência em ganhar elétrons são os ametais das famílias VA (família do Nitrogênio), VIA (Calcogênios) e VIIA (Halogênios).
Além disso, a tabela periódica não foi organizada aleatoriamente. As famílias são numeradas e esse número indica qual é a quantidade de elétrons na camada de valência dos elementos daquela coluna.
Observe:
O sódio é um metal da família IA (alcalinos) e sabemos que ele tem 1 elétron na valência. Por ser um metal, sabemos que tende a perder, se tornando um íon +1.
O oxigênio faz parte da família VIA (calcogênios) e de sua valência é 6. Por ser um ametal, sabemos que tende a ganhar e precisa de 2 para estabilizar, então se tornará um íon -2.
O alumínio é um metal da família IIIA (família Boro) e de fato sua valência é 3. Por ser um metal, tende a perder e se tornar um íon +3.
Cloro é um ametal da família VIIA (halogênios) e de fato sua valência é 7. Por ser um ametal, tende a ganhar 1 elétron de acordo com a regra do octeto. Assim será um íon -1.
Atenção!
Nas antigas tabelas, as colunas mais altas da ponta direita e esquerda eram chamadas de famílias A, então sua numeração era em sequência (IA,IIA,IIIA…) Os elementos que ficam entre essas colunas (mais baixos), eram chamados de família B.
Algumas tabelas novas não fazem essa distinção de A e B, saem enumerando tudo continuamente. Como são 10 colunas na antiga família B, chegamos na antiga família IIIA com a numeração 13.
Essa foi apenas uma pequena reformulação, mas não significa que o número de valência do oxigênio deixou de ser 6 (família VIA) e passou a ser 16 (coluna 16). Se você se deparar com uma tabela dessa, basta subtrair a dezena: 16-10 = 6.
Quais são as características da Ligação Iônica?
- Ficam em estado sólido à temperatura ambiente e assim não conduzem eletricidade
- Sofrem dissociação quando dissolvidos em água (produzem íons livres que passam a conduzir eletricidade se em estado líquido ou aquoso)
- O Ponto de fusão e de ebulição são mais elevados que os dos compostos moleculares
- São moléculas polares
- De forma geral, são solúveis em água
- São duros e quebradiços
- Tem muita resistência à dilatação
- O ganho e a perda de elétrons são representados por uma seta que sai do elétron do metal até o lado esquerdo (vazio) da sigla do ametal
Gostou do nosso artigo sobre o que é ligação iônica? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
O Beduka é o seu maior parceiro quando o assunto é entrar na faculdade. A seguir temos uma oportunidade incrível para você!
Nós conectamos você à faculdade!
Você sabia que é possível entrar na faculdade sem fazer o Enem? Sim! E o melhor, você pode realizar seu sonho e ainda economizar dinheiro.
Conheça o Beduka Bolsas, o programa do Beduka onde você pode encontrar bolsas de estudo com até 65% da mensalidade!]
Faça a faculdade dos seus sonhos, escolhendo entre mais de 90 opções de cursos em nossas universidades parceiras. Temos Direito, Enfermagem, Psicologia e muito mais!
Siga também o Beduka nas redes sociais! Em nosso Instagram você encontra todos os conteúdos que podem cair no Enem e no Pinterest os melhores resumos sobre todas as matérias cobradas no vestibular. É tudo gratuito e pensado em te ajudar a entrar na faculdade!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





