A Isomeria é um fenômeno químico em que dois compostos têm a mesma fórmula molecular, porém, eles são diferentes nas propriedades físicas e químicas. Curioso, não é? Leia nosso resumo e treine com os 9 melhores exercícios sobre Isomeria com gabarito!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- O que é isomeria?
- Quais são os 2 tipos de Isomeria?
- O que é Isomeria Plana e suas 5 subdivisões?
- O que é Isomeria Espacial e suas 2 subdivisões?
- Lista de exercícios sobre Isomeria!
- Respostas dos exercícios de Isomeria.
Quando você terminar as questões sobre Isomeria, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que é isomeria?
Isomeria é o fenômeno em que duas substância químicas diferentes possuem uma mesma fórmula estrutural.
Em outras palavras, essas substâncias são formadas pelos mesmos elementos em quantidades iguais. Porém, as suas estruturas estão organizadas de uma forma distinta.
Como consequência, será formado um novo composto. Ele não possui apenas uma forma diferente, mas também características (temperatura de fusão e ebulição, por exemplo).
Esses compostos de mesma fórmula, mas arranjos estruturais diferentes, sofreram isomeria. Por isso, eles são chamados de isômeros.
- São mais de 200 resumos no Instagram do Beduka!
Quais são os 2 tipos de Isomeria?
Existem dois tipos diferentes de isomeria e cada um deles apresenta as suas subdivisões:
- Isomeria Plana: possui 5 tipos.
- Isomeria Espacial: possui 2 tipos.
Nós temos um artigo completo sobre Isomeria!
Porém, já vamos te mostrar um resumo deles. Acompanhe:
O que é Isomeria Plana?
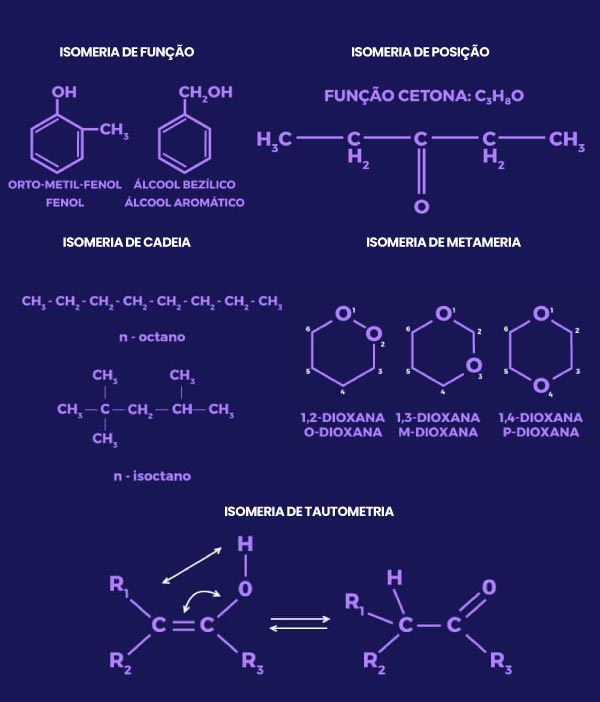
A isomeria plana é a mais simples de enxergar. Basta observar a fórmula estrutural plana dos dois isômeros para entender a diferença.
Ela é subdividida em 5 isomerias diferentes. Vamos esmiuçar cada uma para você.
Isomeria de Função
Essa é a isomeria em que a mudança da posição dos átomos altera a função orgânica do composto. Normalmente, ocorre com a transformação de um fenol em um álcool.
Isomeria de Posição
Essa isomeria é a que a função dos compostos não se altera. O que muda é somente a posição de um determinado radical na estrutura. Ou seja, se está ligado ao primeiro ou ao segundo carbono da cadeia.
Isomeria de Cadeia
Ela também ocorre em compostos de mesmo grupo funcional. Porém, apresentam classificações de cadeias diferentes. Como se uma tivesse ramificação e a outra não.
Isomeria de Compensação (Metameria)
Ela acontece quando um heteroátomo (qualquer átomo no meio da cadeia que não é carbono ou hidrogênio) consegue mudar de posição livremente, sem alterar a função.
Isomeria de Tautomeria
Este é um caso específico da isomeria de função, mas se refere especificamente a dois pares de funções se transformando uma na outra:
Ela acontece entre uma cetona (compostos com carbonila: C=O) e um enol (compostos álcoois com radical OH).
Também pode acontecer entre um aldeído (compostos que possuam carbonila combinada com outro radical) e um enol.
O que é Isomeria Espacial?
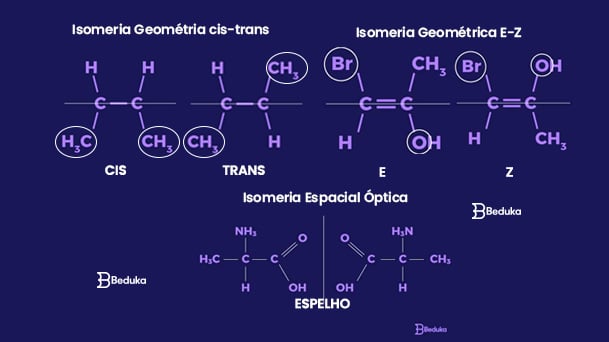
A Isomeria espacial é um pouco mais complexa, porque tanto a fórmula molecular quanto a estrutural plana são iguais (2D).
Então, só conseguimos enxergar a diferença quando observamos a fórmula estrutural espacial (3D).
Existem outros 2 subtipos de isomeria espacial (geométrica e óptica). Veja só:
Isomeria Espacial Geométrica
A isomeria geométrica avalia e compara a posição dos ligantes de uma cadeia no espaço.
Ela sempre ocorre em cadeias abertas com ligações duplas entre carbonos ou em cadeias fechadas. Isso porque a ligação dupla permite uma rotatividade diferente do grupo ligado a ele, podendo estar em cima ou baixo.
Isomeria Geométrica Cis-Trans
- Isomeria Cis: Ligantes iguais no mesmo plano.
- Isomeria Trans: Ligantes iguais em diferentes planos.
Isomeria Geométrica E-Z
- Configuração E: quando os dois diferentes ligantes de maior número atômico estão em planos opostos.
- Configuração Z: quando os dois diferentes ligantes de maior número atômico estão no mesmo plano.
Isomeria Espacial Óptica
A isomeria óptica ocorre em moléculas muito parecidas, só que estão espelhadas. Portanto, não conseguem se sobrepor uma a outra, pois são assimétricas entre si.
A Isomeria Óptica tem a ver com a luz polarizada que incide sobre os isômeros e altera seu comportamento óptico.
Pode parecer pouca coisa, mas os estragos que uma molécula espelhada faz é grave em alguns compostos farmacêuticos!
Classificamos os isômeros ópticos de acordo com a direção para onde eles desviam a luz:
- Dextrogiro: São isômeros ópticos que desviam a luz para a direita.
- Levogiro: São isômeros ópticos que desviam a luz para a esquerda.
- Enantiômero: São isômeros ópticos capazes de desviar a luz nas duas direções.
Como saber se um composto possui isomeria óptica?
Basta saber que isso só acontece em compostos com carbono quiral (um carbono que se liga a quatro elementos diferentes). Assim, podem surgir quatro isômeros ópticos, um para cada elemento diferente que está ligado.
Exercícios sobre Isomeria
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe gratuitamente o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1- (Mackenzie)
Qual é a alternativa que apresenta um par de isômeros planos?
a) metóxi-metano e etano.
b) pentanal e 2-metil-1-butanol.
c) 3-metil-pentano e 2,3-dimetil-butano.
d) 1,2-di-hidróxi-propano e ácido propanóico.
e) trimetilamina e etildimetilamina.
Questão 2- (PUC-MG)
Analise os compostos a seguir.
1. CH3COCH3.
2. CH3COOCH3.
3. CH3CH2CHO.
4. CH3CH2COOH.
5. CH3CH2CH2OH.
6. CH3OCH2CH3.
São isômeros os pares:
a) 1 e 5; 2 e 4.
b) 2 e 4; 3 e 5.
c) 1 e 3; 2 e 4.
d) 3 e 6; 1 e 5.
e) 2 e 4; 3 e 6.
Questão 3- (Uespi)
Quantos isômeros existem com a fórmula C4H10?
a) 2.
b) 1.
c) 3.
d) 4.
e) 5.
Questão 4- (UFJF)
A substância 2-pentanona possui isômeros de posição, de cadeia e de função. Estes isômeros podem ser, respectivamente:
a) 3-pentanona, metil-butanona e pentanal.
b) 3-pentanona, metil-butanona e 2-pentanol.
c) 3-pentanona, etil-butanona e 2-pentanol.
d) 1-pentanona, etil-butanona e pentanal.
e) 1-pentanona, ciclopentanona e 2-pentanol.
- Muito bem! Você está quase na metade das questões de Isomeria!
Questão 5- (ITA)
Um alcano pode ser um isômero de:
a) um alceno com o mesmo número de átomos de carbono.
b) um cicloalcano com a mesma fórmula estrutural.
c) outro alcano de mesma fórmula molecular.
d) um alcino com apenas uma ligação tripla.
e) um alcadieno com o mesmo número de átomos de hidrogênio.
Questão 6- (Unic)
O 1-butanol possui a fórmula molecular C4H10O. Pertencendo ao mesmo grupo funcional, quantos isômeros planos podem ser formados com a mesma fórmula molecular (incluindo o 1-butanol)?
a) Dois.
b) Três.
c) Quatro.
d) Cinco.
e) Seis.
Questão 7- (Cesgranrio)
Quantos éteres diferentes têm fórmula molecular C4H10O?
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
- Ufa, estamos quase lá! Faça as duas últimas questões sobre Isomeria!
Questão 8- (Fesp-PE)
A propanona e o isopropenol são casos típicos de isomeria:
a) de cadeia.
b) de tautomeria.
c) de metameria.
d) de posição.
e) estereoisomeria.
Questão 9- (PUC-MG)
Numere a segunda coluna relacionando os pares de compostos com o tipo de isomeria na primeira coluna:
1. de cadeia ( ) etóxi-propano e metóxi-butano
2. de função ( ) etenol e etanal
3. de posição ( ) etanoato de metila e ácido propanoico.
4. de compensação ( ) 1-propanol e 2-propanol
5. tautomeria ( ) n-pentano e neopentano
A numeração correta encontrada, de cima para baixo, é:
a) 5 – 4 – 2 – 3 – 1.
b) 3 – 1 – 2 – 4 – 5.
c) 5 – 2 – 4 – 3 – 1.
d) 3 – 5 – 1 – 2 – 4.
e) 4 – 5 – 2 – 3 – 1.
- Parabéns, você fez todos os exercícios de Isomeria!
Respostas dos Exercícios de Isomeria
Exercício resolvido da questão 1 –
c) 3-metil-pentano e 2,3-dimetil-butano.
Exercício resolvido da questão 2 –
c) 1 e 3; 2 e 4.
Exercício resolvido da questão 3 –
a) 2.
Exercício resolvido da questão 4 –
a) 3-pentanona, metil-butanona e pentanal.
Exercício resolvido da questão 5 –
c) outro alcano de mesma fórmula molecular.
Exercício resolvido da questão 6 –
c) Quatro.
Exercício resolvido da questão 7 –
c) 3.
Exercício resolvido da questão 8 –
b) de tautomeria.
Exercício resolvido da questão 9 –
e) 4 – 5 – 2 – 3 – 1.
Gostou dos nossos exercícios sobre Isomeria? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, mensalidade e muito mais.
Experimente agora!





