A Pilha produz corrente elétrica a partir da energia química por meio da reação de oxidorredução. Assim, um dos reagentes perde elétrons (oxida) e outro ganha (reduz). Leia nosso resumo e teste os seus conhecimentos com os melhores exercícios sobre Pilhas! O gabarito está logo ao final com a resolução!
Neste artigo, você encontrará todos os temas abaixo. Clique em um dos tópicos abaixo para ir direto ao conteúdo da sua escolha:
- O que são Pilhas e como elas funcionam?
- Quais são os componentes da Pilha?
- Como encontrar a Equação Global da reação?
- O que é ddp e como calculá-lo?
- Lista de exercícios de Pilhas!
- Respostas dos exercícios sobre Pilhas.
Quando você terminar as questões sobre Pilhas, coloque em prática todo seu conhecimento com O Melhor Simulado Enem do Brasil.
O que são Pilhas e como elas funcionam?
A Pilha é um dispositivo em que acontece a produção de corrente elétrica a partir da energia química. É por meio de uma reação de oxidorredução que conseguimos fazer isso, na qual um dos reagentes perde elétrons (oxida) e outro ganha elétrons (reduz).
Ela também pode ser chamada de célula galvânica. É o movimento de elétrons que produz a corrente e a oxirredução ocorre de forma espontânea, até que o reagente se esgote.
Como estamos falando em pilha e oxirredução, podemos representar assim:
- Oxidação: o elemento (X) perde elétron (e–), então se transforma em um cátion (X+).
X → X+ + e–
- Redução: o elemento (Y) ganha elétron (e–), então se transforma em um ânion (Y–).
Y + e– → Y–
Como é feita a pilha? (Componentes básicos e funcionamento)
As pilhas são sempre formadas por dois eletrodos (placas) e um eletrólito (solução):
- Ânodo: é o eletrodo negativo, onde ocorre a reação de oxidação (perda de elétron).
- Cátodo: é o eletrodo positivo, onde ocorre a reação de redução (ganho de elétron).
- Eletrólito: também chamado de ponte salina, é uma solução eletrolítica, ou seja, um meio aquoso capaz de conduzir íons. Por aí que os elétrons cedidos pelo ânodo chegarão até o cátodo.
O funcionamento de uma pilha ocorre a partir dos seguintes princípios:
- 1º Princípio – Oxidação no ânodo: o metal que está no ânodo, por apresentar maior tendência de perder elétrons, transforma-se em um cátion:
Zn → Zn2+ + 2 e–
- 2º Princípio – Redução no cátodo: os cátions que fazem parte do material do cátodo (usamos o cobre como exemplo), recebem os elétrons que vieram do ânodo e transformam-se em cobre metálico:
Cu2+ + 2e– → Cu
Assim, o sentido dos elétrons é sempre do ânodo para o cátodo.
- Veja como funciona cada tipo de pilha (Daniell, Leclanté, Alcalina e Volta) nosso artigo completo sobre Pilhas. Assim você resolverá os exercícios sobre pilhas com mais facilidade ainda!
Como encontrar a equação global da pilha?
Semirreação é quando escrevemos apenas uma parte de uma reação global. Ao longo do texto acima, nós escrevemos várias delas.
Porém, o processo inteiro, do início ao fim, pode ser representado por uma única reação global. Para chegar a ela, precisamos apenas somar as semirreações:
Zn → Zn2+ + 2 e–
+ Cu2+ + 2e– → Cu
Equação global: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
É importante que o número de elétrons entre as semirreações seja o mesmo. Assim, eles não aparecerão na reação final (o mesmo número em lados opostos se anulam) e isso demonstra que o processo ocorreu completamente.
No exemplo, eles já estão iguais, então bastou somar. Caso não estejam, você deve encontrar um número adequado para multiplicar uma ou ambas as semirreações (ela inteira) e chegar a um número igual de elétrons.
O que é Diferença de Potencial (ddp)?
No universo das pilhas, o potencial é um número que representa o quão grande é a tendência de perder ou ganhar elétrons daquela substância.
- Se analisarmos sua tendência a ganhar elétrons, estamos falando do potencial padrão de redução (E°Red).
- Se analisarmos sua tendência a perder elétrons, estamos falando do potencial padrão de oxidação (E°Oxi).
A dpp significa diferença de potencial e é simplesmente o valor que obtemos depois de subtrair determinados potenciais.
Fique tranquilo porque esses valores costumam vir escritos na questão ou te darão uma tabela. Sempre confira se os potenciais escritos ali são de redução ou de oxidação!
- Veja explicações mais detalhadas, com exemplos, no nosso artigo completo sobre Pilhas.
Como calcular a ddp?
A tensão elétrica gerada quando os elétrons se deslocam e geram corrente é indicada sempre pela unidade Volts (símbolo V). Com o cálculo da dpp descobrimos esse valor.
Para calcular a ddp, é necessário já saber os potenciais de redução ou de oxidação de cada um dos eletrodos.
Depois disso, basta subtrair o menor do maior, assim:
ΔE = E°Red maior – E°Red menor
ou
ΔE = E°Oxi maior – E°Oxi menor
Atenção!
Saiba que os potenciais de um mesmo elemento, seja de redução ou oxidação, possuem o mesmo valor numérico.
A diferença é que o de oxidação tem um sinal negativo e o de redução tem um sinal positivo. Portanto, se uma questão te der o E°Red de um e o E°Oxi de outro, basta inverter o sinal de apenas um deles!
Lista de exercícios sobre Pilhas com gabarito
Esperamos que, com esse resumo, tudo tenha ficado mais claro para você.
Parabéns por ter lido até aqui!
Baixe o Plano de Estudos do Beduka e tenha uma preparação perfeita para o ENEM.
Questão 1 – (UFRGS-RS)
Pessoas que apresentam dentes com restaurações metálicas podem sentir um pequeno choque ao colocarem na boca pedaços de metal, como, por exemplo, o papel alumínio de um chocolate. O alumínio, com meio ácido da boca, provoca a transferência de elétrons para o metal da restauração, causando esse choque.
Com base no fenômeno descrito, pode-se afirmar que o alumínio
a) sofre redução, funcionando com cátodo.
b) provoca a oxidação do metal da restauração.
c) é o agente oxidante, pois sofre redução.
d) é o agente redutor, pois sofre redução.
e) sofre oxidação, funcionando como ânodo.
Questão 2 – (UFU-MG)
Quando a pilha mostrada a seguir está em funcionamento, a barra de chumbo vai se desgastando e a prata vai ficando mais espessa.
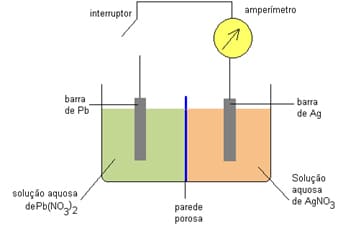
No início do experimento, as duas barras apresentavam as mesmas dimensões. Para essa pilha determine:
a) As equações das semirreações de oxidação e redução;
b) A equação química da reação global;
c) O sentido de movimento dos elétrons na parte externa do circuito e o sentido dos íons na parede porosa.
- Você já fez 20% da lista de exercícios sobre Pilhas. Continue assim!
Questão 3 – (Vunesp)
A equação seguinte indica as reações que ocorrem em uma pilha:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Podemos afirmar que:
a) O zinco metálico é o cátodo
b) O íon cobre sofre oxidação.
c) O zinco metálico sofre aumento de massa.
d) O cobre é o agente redutor.
e) Os elétrons passam dos átomos de zinco metálico aos íons de cobre.
Questão 4 – (PUC)
Na cela eletroquímica representada pela equação:
Ni0 + 2Ag+ → Ni2+ + 2Ag0
é correto afirmar que:
a) os elétrons fluem, pelo circuito externo, da prata para o níquel.
b) o cátodo é o eletrodo de níquel.
c) o eletrodo de prata sofre desgaste.
d) a prata sofre redução.
e) a solução de níquel irá se diluir.
Questão 5 – (FUC-MT)
Nas pilhas eletroquímicas obtém-se corrente elétrica devido à reação de oxidorredução.
Podemos afirmar que:
a) no cátodo, ocorre sempre a semirreação de oxidação.
b) no cátodo, ocorre sempre a semirreação de redução.
c) no ânodo, ocorre sempre a semirreação de redução.
d) no ânodo, ocorre sempre a oxidação e a redução simultaneamente.
e) no cátodo, ocorre sempre a oxidação e a redução simultaneamente.
- Muito bem! Você chegou à metade dos exercícios sobre Pilhas!
Questão 6 – (CESGRANRIO-RJ)
Considere a pilha representada abaixo.
Cu(s)/ Cu2+ || Fe3+, Fe2+ / Pt(s)
Assinale a afirmativa falsa.
a) A reação de redução que ocorre na pilha é: Cu2+ + 2 e– → Cu(s)
b) O eletrodo de cobre é o ânodo.
c) A semi-reação que ocorre no cátodo é Fe3+ + e– → Fe2+.
d) A reação total da pilha é: 2 Fe3+ + Cu → 2 Fe2+ + Cu2+
e) Os elétrons migram do eletrodo de cobre para o eletrodo de platina
Questão 7 – (UNIFESP-SP)
Ferro metálico reage espontaneamente com íons Pb2+, em solução aquosa. Esta reação é representada por:
Fe + Pb2+ → Fe2+ + Pb
Na pilha representada pela figura
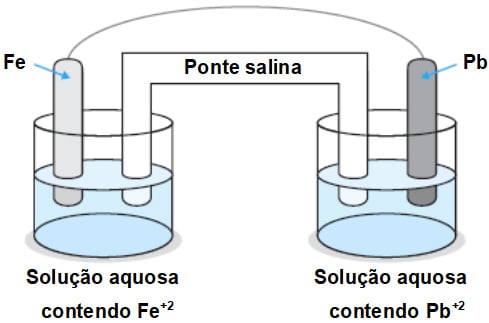
Em que ocorre aquela reação global,
a) os cátions devem migrar para o eletrodo de ferro.
b) ocorre deposição de chumbo metálico sobre o eletrodo de ferro.
c) ocorre diminuição da massa do eletrodo de ferro.
d) os elétrons migram através da ponte salina do ferro para o chumbo.
e) o eletrodo de chumbo atua como ânodo.
Questão 8 – (PUC-RIO 2008)
O trabalho produzido por uma pilha é proporcional à diferença de potencial (ddp) nela desenvolvida quando se une uma meia-pilha onde a reação eletrolítica de redução ocorre espontaneamente (catodo) com outra meia pilha onde a reação eletrolítica de oxidação, ocorre espontaneamente (anodo).
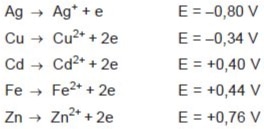
Com base nas semi-reações eletrolíticas acima, colocadas no sentido da oxidação, e seus respectivos potenciais, assinale a opção que indica os metais que produzirão maior valor de ddp quando combinados para formar uma pilha.
a) Cobre como cátodo e prata como ânodo.
b) Prata como cátodo e zinco como ânodo.
c) Zinco como cátodo e cádmio como ânodo.
d) Cádmio como cátodo e cobre como ânodo.
e) Ferro como cátodo e zinco como ânodo.
- Ufa, estamos quase lá! Faça os 2 últimos exercícios de Pilhas.
Questão 9 – (FUVEST)
Considere os potenciais padrões de redução:
semi-reação (em solução aquosa) potencial (volt)
Ce4+ + 1e– ® Ce3+ +1,61
Sn4+ + 2e– ® Sn2+ +0,15
Qual das reações deve ocorrer espontaneamente?
a) Ce4+ + Sn4+ ® Ce3+ + Sn2+
b) 2Ce4+ + Sn2+ ® 2Ce3+ + Sn4+
c) Sn4+ + Ce3+ ® Ce4+ + Sn2+
d) Ce3+ + Sn2+ ® Ce4+ + Sn4+
Questão 10 – (ENEM 2017)
A invenção do LED azul, que permite a geração de outras cores para compor a luz branca, permitiu a construção de lâmpadas energeticamente mais eficientes e mais duráveis do que as incandescentes e fluorescentes.
Em um experimento de laboratório, pretende-se associar duas pilhas em série para acender um LED azul que requer 3,6 volts para o seu funcionamento. Considere as semirreações de redução e seus respectivos potenciais mostrados no quadro.

Qual associação em série de pilhas fornece diferença de potencial, nas condições-padrão, suficiente para acender o LED azul?
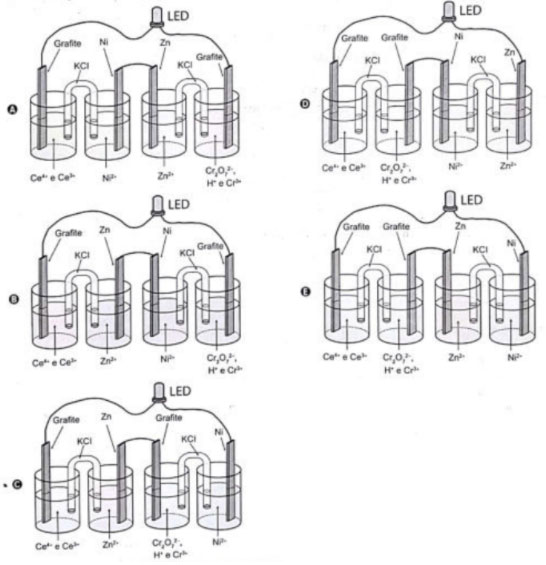
- Parabéns, você fez todas as questões sobre Pilhas. Confira agora o Gabarito:
Gabarito Resolvido da lista de exercícios sobre Pilhas
Exercício resolvido da questão 1 –
Alternativa correta: e) sofre oxidação, funcionando como ânodo.
Se o alumínio está transferindo elétrons, concluímos que ele está oxidando. Em uma pilha, quem oxida é o ânodo.
Exercícios sobre Pilhas resolvidos da questão 2 –
Resposta da pergunta a) : Semirreação do ânodo: 1 Pb(s) → 1 Pb2+(aq) + 2e- / Semirreação do cátodo: 2 Ag2+(aq) + 2e-→2 Ag(s)
Resposta da pergunta b) : Reação Global: 1 Pb(s) 2 Ag2+(aq) → 1 Pb2+(aq) + 2 Ag(s)
Resposta da pergunta c) : Os elétrons movimentam-se do ânodo (eletrodo de chumbo) para o cátodo (eletrodo de prata). Os cátions dirigem-se do ânodo para o cátodo e os ânions dirigem-se do cátodo para o ânodo.
Exercício resolvido da questão 3 –
Alternativa correta: e) Os elétrons passam dos átomos de zinco metálico aos íons de cobre.
A equação nos mostra que, no início, tínhamos Zn e Cu2. Ao final, o Zn se transformou em Zn+2 (perdeu 2 elétrons, oxidou, polo negativo) e o Cu2 se tornou Cu (ganhou 2 elétrons do zinco, reduziu, polo positivo).
Exercício resolvido da questão 4 –
Alternativa correta: d) a prata sofre redução.
A reação global Ni0 + 2Ag+ → Ni2+ + 2Ag0 é formada pelas duas semirreações a seguir:
ânodo (polo negativo onde ocorre a oxidação ou perda de elétrons): Ni0→ Ni2+ + 2 e-
cátodo (polo positivo onde ocorre a redução ou ganho de elétrons): Ag+ + e- → Ag0
Assim, temos que:
A prata (Ag) ganhou elétrons, sofrendo redução.
Exercício resolvido da questão 5 –
Alternativa correta: b) no cátodo, ocorre sempre a semirreação de redução.
Nas pilhas eletroquímicas, o cátodo (polo positivo) é onde ocorre a redução, e o ânodo (polo negativo) é onde ocorre a oxidação.
Exercício resolvido da questão 6 –
Alternativa correta: a) A reação de redução que ocorre na pilha é: Cu2+ + 2 e– → Cu(s)
enunciado fornece a notação de uma pilha, utilizada mundialmente:
Cu(s)/ Cu2+ || Fe3+, Fe2+ / Pt(s)
Na qual os componentes à esquerda da barra dupla (II) indicam a espécie que oxidou (no caso o cobre-Cu), enquanto que os da direita indicam a espécie que reduziu (Fe3+, Fe2+):
Alternativa A é a falsa porque o cobre é a espécie que sofre oxidação (perde elétrons): Cu(s) → Cu2+ + 2 e–
Exercício resolvido da questão 7 –
Alternativas corretas: c) ocorre diminuição da massa do eletrodo de ferro.
Analisando a equação eletroquímica fornecida pelo enunciado:
Fe + Pb2+ → Fe2+ + Pb
Temos o ferro neutro (Fe) no reagente e o cátion ferro II (Fe+2) no produto, fato este que indica a oxidação do ferro. Além disso, temos no reagente o cátion chumbo II (Pb+2) e o chumbo neutro (Pb) no produto, fato este que indica a redução do cátion chumbo.
Alternativa C é correta porque o ferro metálico está sofrendo oxidação, formando o cátion ferro II que é dissolvido na água;
Exercício resolvido da questão 8 –
Alternativa correta: b) Prata como cátodo e zinco como ânodo.
De acordo com o cálculo de ddp, precisamos pegar o de maior padrão de oxidação e subtrair o de menor padrão de oxidação. Para obter uma diferença numérica grande (a maior possível), pegamos o elemento que tem maior E°oxi (zinco) e o que tem menor E°oxi (prata).
Assim, sabemos que a prata irá reduzir (cátodo) já que tem o menor E°oxi e o zinco irá oxidar (ânodo) já que tem o maior E°oxi.
Exercício resolvido da questão 9 –
Alternativa correta: b) 2Ce4+ + Sn2+ ® 2Ce3+ + Sn4+
De acordo com o valor dos potenciais, sabemos que o elemento Ce irá reduzir porque tem um E°red maior. Quando ele reduz, deixa de ser Ce+4 e se torna Ce+3, portanto, devemos encontrar um Ce+3 nos produtos da reação.
Já que o elemento Sn irá oxidar, precisamos encontrar a espécie contrária ao que foi dado, porque foi dado como E°red.
Se no E°red a espécie inicial era Sn+4 e se tornava Sn+2, já que sabemos que ele vai reduzir, irá acontecer: Sn+2 se tornando Sn+4 no produto da reação.
A única opção que tem Sn+4 e Ce+3 nos produtos é a letra b.
Exercício resolvido da questão 10 –
Alternativa correta: c)
Para associar duas pilhas em série, é preciso que tenha o polo negativo de uma pilha associado ao polo positivo da outra pilha.
Vamos analisar quais associações são possíveis antes de calcular as ddpsl:
Associação letra a:
Segundo a tabela fornecida, o Ce tem potencial de redução maior do que o Ni, portanto o Ce reduz (polo positivo) e o Ni oxida (polo negativo). O Cr2O7 tem potencial de redução maior do que o Zn, portanto o Cr2O7 reduz (polo positivo) e o Zn oxida (polo negativo).
Assim, teríamos Ce (+) — Ni (-) — Zn (-) — Cr2O7 (+). (NÃO pode, porque há dois negativos encostados)
Associação da letra b:
O Ce tem potencial de redução maior do que o Zn, portanto o Ce reduz (polo positivo) e o Zn oxida (polo negativo). O Cr2O7 tem potencial de redução maior do que o Ni, portanto o Cr2O7 reduz (polo positivo) e o Ni oxida (polo negativo).
Assim, teríamos Ce (+) — Zn (-) — Ni (-) — Cr2O7 (+). (NÃO pode, porque há dois negativos encostados)
Associação da letra c:
O Ce tem potencial de redução maior do que o Zn, portanto o Ce reduz (polo positivo) e o Zn oxida (polo negativo). O Cr2O7 tem potencial de redução maior do que o Ni, portanto o Cr2O7 reduz (polo positivo) e o Ni oxida (polo negativo).
Assim, teríamos: Ce (+) — Zn (-) — Cr2O7 (+) — Ni (-). (PODE, porque não há dois polos iguais em contato)
Associação da letra d:
O Ce tem potencial de redução maior do que o Cr2O7, portanto o Ce reduz (polo positivo) e o Cr2O7 oxida (polo negativo). O Ni tem potencial de redução maior do que o Zn, portanto o Ni reduz (polo positivo) e o Zn oxida (polo negativo).
Assim, teríamos: Ce (+) — Cr2O7 (-) — Ni (+) — Zn (-). (PODE, porque não há dois polos iguais em contato)
Associação da letra e:
O Ce tem potencial de redução maior do que o Cr2O7, portanto o Ce reduz (polo positivo) e o Cr2O7 oxida (polo negativo). O Zn tem potencial de redução maior do que o Ni, portanto o Ni reduz (polo positivo) e o Zn oxida (polo negativo).
Assim, teríamos:Ce (+) — Cr2O7 (-) — Zn (-) — Ni (+). (NÃO pode, porque há dois negativos encostados)
Agora, faremos os cálculos apenas com as associações possíveis (c e d):
ddp total = ddp(pilha1) + ddp(pilha2)
c:
ddp total = (+1,61 + 0,76) + (+1,33 + 0,25)
ddp total = +3,95V [É MAIOR QUE 3,6]
d:
ddp total = (+1,61 – 1,33) + (-0,25 + 0,76)
ddp total = +0,79V
Apenas a associação c é aceitável!
Gostou do nosso artigo com os exercícios sobre Pilhas? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet!






2 Comentários
questões 8 e 10 com valores errados e a explicação não condiz com oq está sendo apresentado na questão
Oi, Jp! Onde os valores estão errados, no enunciado, na resposta?