As Leis Volumétricas são relações matemáticas que descrevem o comportamento dos volumes dos gases e líquidos. A Lei Volumétrica de Gay-Lussac é a principal e serve para as reações químicas em condições de pressão e temperatura constantes. Nesse contexto, os volumes seguirão uma proporção fixa, formada de números pequenos e inteiros.
Neste artigo sobre Leis volumétricas, você encontrará:
- O que são e quais são as Leis volumétricas?
- Lei de Gay Lussac, Charles e Avogadro
- Diferença entre Leis ponderais e Leis volumétricas
- Lei geral dos Gases
- Estudando para as provas? Conheça o melhor Simulado do Brasil, que pode ser personalizado com as matérias que você mais precisa!
O que são as Leis volumétricas?
As Leis Volumétricas são um conjunto de relações matemáticas sobre o comportamento dos volumes durante as reações químicas. Por esse motivo, elas tratam de situações que costumam envolver gases e líquidos.
Alguns cientistas estudaram essas reações e viram que existia um certo padrão de comportamento dos volumes, em situações específicas. Esses padrões podem ser traduzidos em linguagem matemática e é isso que vamos estudar agora!
Reações químicas são um conjunto de ações que acontecem entre duas ou mais substâncias. Elas dão origem a diferentes compostos químicos e são representadas como uma equação: A + B → C + D.
Os Reagentes (A e B) são as substâncias que irão sofrer as mudanças, elas aparecem no primeiro membro da equação. Os Produtos (C e D) são as substâncias que serão formadas, elas aparecem no segundo membro. Pode formar 1 ou mais produtos.
Essas substâncias podem estar em qualquer estado físico, mas estamos olhando especificamente para o volume. Então, os fenômenos serão melhor observados nos gases e líquidos.
O que são as leis ponderais?
As Leis Ponderais são um conjunto de relações matemáticas sobre o comportamento das massas nas reações químicas. As três Leis mais famosas são: Lei de Lavoisier (Lei da Conservação de Massas), Lei de Proust (Lei das Proporções Definidas) e Lei de Dalton (Lei das Proporções Múltiplas).
A diferença é que as ponderais falam sobre as massas e as volumétricas sobre os volumes. Saber todas elas são importantes para você se preparar bem para o vestibular!
- Veja nosso artigo completo e exclusivo sobre as Leis Ponderais!
Quais são as 3 Leis Volumétricas?
As três principais Leis Volumétricas são:
- 1° Lei de Gay Lussac (Lei da combinação de volumes)
- Lei de Charles
- Lei de Avogadro
Alguns livros didáticos vão falar apenas da Lei de Gay Lussac e considerar as outras duas como extensões dela.
Isso acontece porque o Lussac foi o primeiro a elaborar Leis voltadas para o volume. As outras foram desenvolvidas por ele em parceria com os demais cientistas.
Independente da forma como as Leis são divididas, você apenas precisa saber o principal nome e entender quais princípios elas apontam. Lembre-se sempre que o contexto são reações que envolvem gases e líquidos, pois observamos os volumes!
Vamos entender cada uma separadamente:
Lei Volumétrica de Gay-Lussac (Combinação de Volumes)

Joseph Louis Gay-Lussac foi um cientista do século XVIII que fez estudos importantes sobre os gases. Ele produziu água reagindo os gases hidrogênio e oxigênio e, nessas tentativas, observou que as substâncias sempre reagiam em uma mesma proporção!
Por isso, Gay-Lussac formou a Lei da Combinação de Volumes, Ela diz:
“Nas mesmas condições de temperatura e pressão, os volumes dos gases dos reagentes e dos produtos de uma reação química têm sempre entre si uma relação de números inteiros e pequenos.”
-Gay Lussac
Essa Lei também pode ser chamada de 1° Lei de Gay-Lussac, a mais importante das Leis Volumétricas.
- Não entendeu nada? Vamos explicar com um exemplo:
Vamos supor uma reação química entre os gases hidrogênio e oxigênio que forma vapor de água. Ela deve ser feita em um ambiente que mantenha sua temperatura e pressão estáveis (sem mudar).
De acordo com as tentativas, podemos montar a tabela indicando os experimentos e seus resultados:
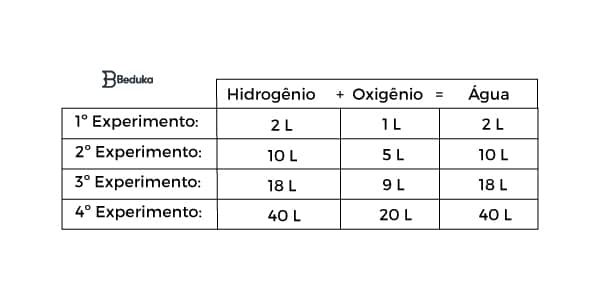
Observe que em todos os experimentos existe uma proporção de volumes dada por 2 : 1 : 2.
Para observar esse padrão, basta simplificar os volumes encontrando um denominador comum entre eles. Exemplo:
No 2° experimento, os volumes são 10 , 5 e 10. O MDC (máximo divisor comum) desses valores é o 5. Dividindo cada um desses números por 5, chegamos em 2, 1 e 2. Portanto, nessa reação química a proporção dos volumes é formada por números inteiros e pequenos (2 e 1).
- Em cada tipo de reação sempre há uma relação desse tipo entre os volumes. Porém, a proporção podem ser dados por outros números de acordo com quem reage.
Observe este outro exemplo para entender:
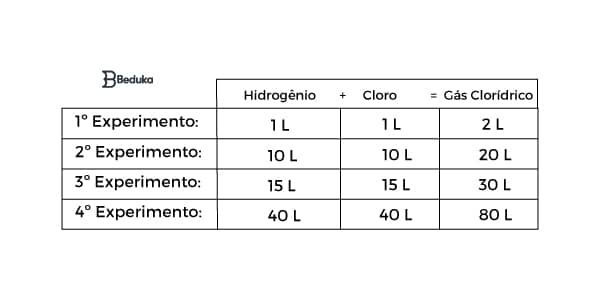
Se você realizar as contas seguindo o modelo do anterior, chegará que a proporção que define a formação de gás clorídrico é dada por 1 : 1 : 2.
O MDC entre 10 e 20 é 10, logo, 10/10 =1 e 20/10 = 2. Chegamos à: 1 : 1 : 2.
Lei de Avogadro
A teoria atômica mais aceita nessa época era a de Dalton (a matéria é formada por minúsculas partículas maciças e indivisíveis). Por causa disso, acreditavam que a quantidade de átomos deveria ser constante na reação química e o volume dos produtos deveria ser a soma dos volumes dos reagentes.
Porém, os experimentos de Gay-Lussac mostraram que essa parte da teoria estava errada! Veja que isso não acontece na reação química de formação da água. Se lembrarmos da proporção 2 : 1 : 2 , vemos que o produto deveria ter 3L (2 + 1), mas teve apenas 2L.
Lussac percebeu que algumas reações geravam contração de volume, mas foi Avogadro que explicou o porquê disso acontecer!
Isso significa que os gases não seriam sempre formados por átomos isolados (só os gases nobres), mas que eles são moléculas (diferentes átomos unidos que criam outros comportamentos).
Assim, os átomos dessas substâncias se recombinam durante a reação química, explicando as proporções observadas nas moléculas formadas.
Isso levou a outra conclusão importante: quando comparamos volumes iguais de gases diferentes, eles sempre terão a mesma quantidade de moléculas se forem observados em uma mesma condição de pressão e temperatura.
- Foi a partir disso que ele criou o número ou constante de Avogadro, algo tão usado na química e importante para compreender as Leis Ponderais.
E a Lei de Charles?
A 2ª e a 3° Lei de Gay-Lussac também podem ser chamadas de Lei de Charles. Elas receberam essa variedade de nomes porque contou com a participação do cientista francês Jacques Alexandre Cesar Charles.
- Essa matéria pertence mais à física (termodinâmica dos gases) do que à química. Porém, citamos elas aqui porque foi dada pelo mesmo cientista e são complementares.
Resumidamente:
Uma fala sobre o comportamento dos gases quando o volume não pode mudar, ou seja, situação de volume constante. Nesse caso, a temperatura irá aumentar proporcionalmente à pressão aplicada. Se uma aumenta, a outra aumenta também e vice-versa. Essa é a Lei das transformações isocóricas.
A outra fala sobre o comportamento dos gases quando a pressão não pode mudar, ou seja, situação de pressão constante. Eles observaram que a temperatura irá aumentar proporcionalmente à mudança do volume. Se um aumenta, o outro aumenta também e vice-versa. Essa é a Lei das transformações isobáricas.
- O que diz a lei geral dos gases?
A Lei geral dos gases ou Lei combinada dos gases é a síntese de tudo o que estudamos nas Leis volumétricas e na Termodinâmica dos gases. Ela combina a lei de Boyle, a lei de Charles e a lei de Gay-Lussac. Resumindo, pode ser definida pela equação geral dos gases ideais:
P.V = n.r.T
Em que:
- P = Pressão em atm
- V = volume em L
- n = número de mols
- r = constante dos gases ideais
- T = temperatura em K°
Gostou do nosso artigo sobre Leis volumétricas? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





