As leis ponderais são afirmações sobre o comportamento das massas, obtidas através de experimentos com reações químicas. Lavoisier, Proust e Dalton foram cientistas que elaboraram cada uma das 3 leis, observando a razão e a proporção das massas. Para entender mesmo o que são Leis Ponderais, confira os cálculos dos exemplos
Neste artigo sobre o que são Leis Ponderais, você encontrará:
- O que são Leis Ponderais
- Quais são as 3 leis ponderais?
- Qual a importância das leis ponderais?
- Lei de Lavoisier
- Lei de Proust
- Lei de Dalton
- Estudando para as provas? Conheça nosso Simulado gratuito, que pode ser personalizado com as matérias que você mais precisa!
O que são Leis Ponderais
As Leis Ponderais são um conjunto de três afirmativas sobre o comportamento das massas durante as reações químicas.
Reações químicas são ações que ocorrem entre duas ou mais substâncias e dão origem a diferentes compostos. Elas são representadas de forma genérica como uma equação em que reagentes aparecem no primeiro membro e os produtos, no segundo.
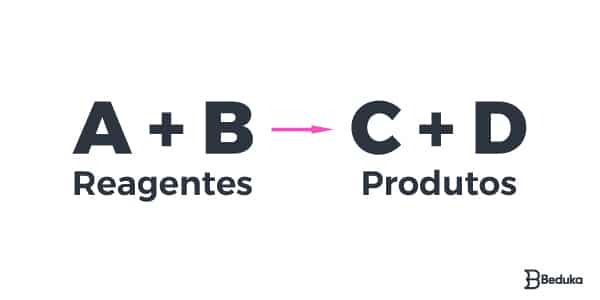
A e B antes da seta são aqueles compostos iniciais que promovem a reação, por isso são chamados de reagentes. A seta indica o sentido da reação. As substâncias C e D são originadas a partir de A e B, por isso são chamadas de produtos.
Assim, durante os experimentos que foram feitos com diversas reações químicas, observou-se padrões de comportamento que podiam ser escritas com cálculos que envolvem proporção e razão. Quando são observadas nos volumes das substâncias, referem-se à Lei de Gay Lussac ou leis volumétricas.
Porém, quando esse cálculo é observado nas massas das substâncias, são chamadas de Leis Ponderais.
Quais são as 3 leis ponderais?
As Leis Ponderais surgiram no final do Século XVIII e vários químicos e estudiosos da época possuem participação na elaboração. Hoje, elas são um agrupamento de 3 leis, cada uma de um cientista.
As três Leis ponderais mais famosas são:
- Lei de Lavoisier ou Lei da Conservação de Massas
- Lei de Proust ou Lei das Proporções Definidas
- Lei de Dalton ou Lei das Proporções Múltiplas
Cada uma dessas leis recebe o nome do cientista que realizou o experimento decisivo para a confirmação. Também recebem o nome da característica observada, ou seja, da descoberta feita. Por isso, podem ser chamadas por ambos os nomes acima.
A seguir, veremos cada uma delas.
Qual a importância das leis ponderais?
As Leis Ponderais foram muito importantes para o avanço da química, da medicina e da farmácia.
Com essas observações e descobertas feitas, foi possível avançar na formação e manipulação de medicamentos, pilhas, e compostos cada vez mais eficientes, pois os cálculos eram mais precisos.
Além disso, elas são essenciais para a resolução das questões de química dos vestibulares e do Enem! Não deixe de estudá-las para se preparar para as provas!
Lei de Lavoisier ou Lei da Conservação de Massas

“Na natureza, nada se cria, nada se perde, tudo se transforma.” (Antoine Lavoisier)
Antoine-Laurent Lavoisier é considerado o pai da Química Moderna. Ele realizou muitos experimentos em sistemas fechados, ou seja, que não permitem troca de matéria entre os meios. Assim, era garantido que tudo o que reagisse seria somente os elementos postos.
Com isso, ele verificou que a soma das massas dos reagentes antes da reação era igual à soma das massas dos produtos após a reação.
Foi por esse motivo que ele propôs aquela frase do início do tópico: observou que a massa dos reagentes não se perdiam, apenas se transformavam em produtos.
Veja a generalização da lei de Lavoisier em termos matemáticos e acompanhe o exemplo numérico a seguir:
- Em um sistema fechado: mA + mB = mC + mD
Considere a reação entre a substância A e a substância B, que forma os produtos C e D, como na equação a seguir:
A + B → C + D
Se reagirmos 10 g de A com 20 g de B e a reação ocorrer em um sistema fechado, a massa do produto C será igual a quantos gramas, sabendo que já produziu 5g de D?
mA + mB = mC + mD
10 + 20 = mC + 5
mC = 30 – 5
mC = 25g
Lei de Proust ou Lei das Proporções Definidas

“Toda substância possui uma proporção constante, em massa, na sua composição, e a proporção na qual reagem e se formam é constante.” (Joseph Louis Proust)
Joseph Louis Proust era um químico e farmacêutico francês. Ele notou que os elementos participantes da composição de uma substância pura, sempre apresentavam uma proporção de massa.
Confuso? Vamos entender com um exemplo para clarear:
Considere como exemplo a produção de ácido clorídrico (HCl) utilizando gás cloro (Cl2) e gás hidrogênio (H2):
Cl2 + H2 → 2HCl / Gás cloro + gás hidrogênio → ácido clorídrico
Agora, vamos imaginar três experimentos com diferentes massas para fazer essa reação:
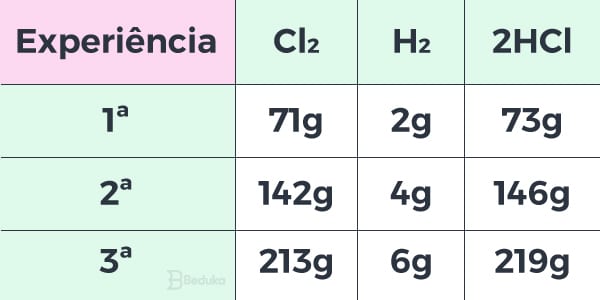
- No primeiro, utilizamos 71 g de Cl2 com 2 g de H2, obtendo 73 g de HCl.
- No segundo, utilizamos 142g de Cl2 com 4 g de H2, formando 146 g de HCl.
- No terceiro, utilizamos 213 g de Cl2 com 6 g de H2, formando 219g de HCl.
Quando relacionamos dividimos as massas dos reagentes em cada experimento, precisamos dividí-las para encontrar a razão.
- Primeiro: 2 / 71
- Segundo: 4 / 142, simplificando a fração por 2, temos 2 /71
- Terceiro: 6 / 213, simplificando a fração por 3, temos 2 /71
Logo percebemos que, para formar ácido clorídrico, a proporção que deve existir entre a quantidade de reagentes é sempre de 2 para 71.
Assim, se utilizarmos 20g de H2, conseguimos calcular pela regra de três que a quantidade de Cl2 para reagir adequadamente será de:
2 – 71
20 – x
multiplicando cruzado temos:
2x = 71.20
2x = 1420
x = 710 g
Lei de Dalton ou Lei das Proporções Múltiplas

“Quando dois elementos formam duas ou mais substâncias compostas diferentes, se a massa de um deles permanecer fixa a do outro irá variar em uma relação de números inteiros e pequenos”. (John Dalton)
John Dalton foi um químico e físico inglês responsável por uma das teorias atômicas. Na química, ele observou que uma mesma quantidade de massa de A, combinada com diferentes quantidades de massas de B, pode formar produtos distintos. Ainda assim, a razão das massas de B, que variam, resulta em números inteiros e pequenos.
Confuso? Calma! Vamos ao exemplo:
O nitrogênio pode formar diferentes óxidos dependendo da massa combinada. Para essa reação, utilizamos o gás nitrogênio (N2) e o gás oxigênio (O2) como reagentes.
N2 + ½ O2 → N2O
Essa é a reação-padrão entre o nitrogênio (N2) e o oxigênio (O2), formando um óxido com 2 átomos de nitrogênio e 1 átomo de oxigênio (N2O). Se variarmos a massa de oxigênio, mantendo a de nitrogênio, é possível formar outros óxidos.
Como a Lei manda, vamos manter a massa do nitrogênio constante e variar a massa do oxigênio. Observe o quadro a seguir:
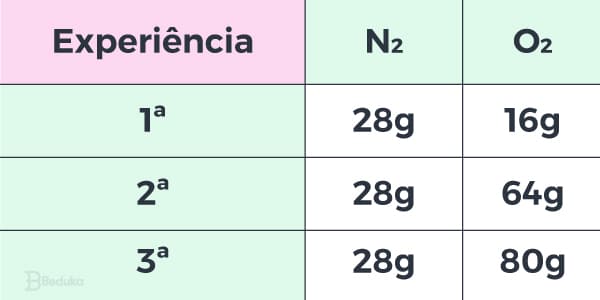
Neste momento não é necessário saber como os outros óxidos serão gerados (N2O4 e N2O5), porque o que nos importa é a razão entre as massas do reagente variante (O2).
Como sabemos que esses são experimentos reais e corretos, vamos analisar apenas essa razão:
- Pegando a massa de O2 do 2° experimento pelo 1°, temos: 64 / 4 = 16
- A razão entre as massa de O2 do 3° experimento pelo 1 é: 80 / 16 = 5
- Já a massa do 3° pelo 2° é: 80 / 64 = 1,25
Se analisarmos os experimentos de todos os óxidos possíveis de serem formados, veremos que a razão do reagente variante sempre resulta em um número inteiro e pequeno, nunca em um número racional, irracional ou complexo.
Gostou do nosso artigo sobre o que são Leis Ponderais? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!





