A Afinidade eletrônica, também chamada de Eletroafinidade, é a quantidade de energia liberada quando um átomo neutro no estado gasoso ganha um elétron. Ela é uma propriedade periódica inversa ao raio atômico e o elemento de maior afinidade é o Cloro (Cl), bem como a família dos halogênios. Pode, ainda, aparecer como negativa ou positiva.
Neste texto sobre Afinidade eletrônica, você encontrará os tópicos abaixo. Clique em um deles para ir diretamente ao conteúdo:
- Introdução e conceitos importantes.
- O átomo.
- A Camada de valência.
- Propriedades da Tabela Periódica.
- O que é Afinidade Eletrônica?
- Como identificar Eletroafinidade na Tabela Periódica?
- Raio atômico e sua influência.
- Quem tem maior Afinidade Eletrônica?
- Porquê o Cloro tem a maior Eletroafinidade?
- Eletroafinidade Negativa e Positiva.
- Diferença entre Eletroafinidade, Eletronegatividade e Energia de Ionização.
- Estudando para as provas? Conheça O melhor Simulado do Brasil! Ele pode ser personalizado com as matérias que você mais precisa!
Introdução: conceitos importantes para compreender Eletroafinidade.
Antes de explicar propriamente o que é afinidade eletrônica e suas propriedades, nós precisamos resgatar alguns conceitos. Vamos usar muitos termos específicos, então é preciso já ter o conhecimento prévio de algumas coisas.
Aqui, deixaremos apenas um resumo dos significados para te ajudar a lembrar. Não deixe de ler os links dos artigos que colocaremos durante a leitura, eles te farão ter uma noção mais completa da matéria!
O que é o átomo?
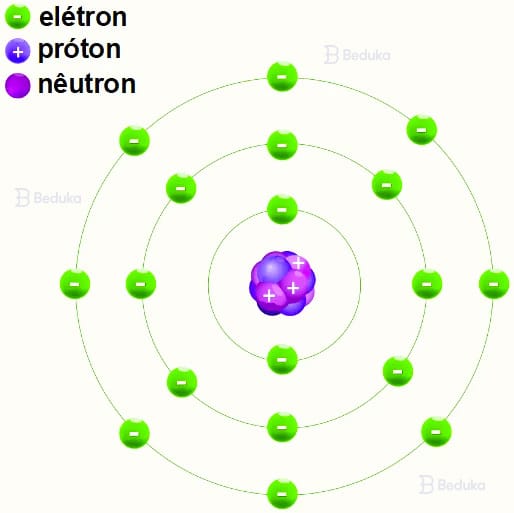
O átomo é a unidade básica da matéria, ou seja, tudo o que conhecemos é formado por um certo número de átomos. Além disso, aprendemos que os átomos têm um formato de “sistema solar”.
No meio da estrutura fica o núcleo, como se fosse o “sol”. Ele é formado pelos prótons (cargas positivas) e os nêutrons (neutros). Ao redor do núcleo, ficam os elétrons (negativos) que são representados como e-. São como os “planetas” do sistema.
Cada “órbita” de elétrons é chamada de camada ou nível eletrônico. O átomo pode ter até 7 camadas e cada uma delas suporta uma quantidade de elétrons. À medida que vai sendo preenchida, o restante passa à próxima.
Você já deve ter ouvido falar que os opostos se atraem e, na química, isso é verdade. A estrutura do átomo só se mantém firme porque elétrons (-) e prótons (+) se atraem mutuamente, equilibrando suas forças e ficando nesse formato.
Os cientistas observaram que cada tipo de átomo corresponde a um elemento. Assim, cada elemento é identificado pela quantidade de prótons, nêutrons e elétrons que seu átomo possui.
Camada de valência e Regra do Octeto
Nós também sabemos que os elementos reagem entre si, formando moléculas ou íons. Mas porque isso acontece?
Os cientistas notaram que os únicos elementos que não reagem são os gases nobres. Eles já têm 8 elétrons na última camada atômica e ficam estáveis assim.
Os demais elementos precisam atingir 8 elétrons na última camada (chamada de valência) para que fiquem mais estáveis. A única exceção é o hidrogênio, que fica estável com 2, então só precisa receber 1 elétron.
Assim, os elementos reagem numa tentativa de compartilhar ou ceder elétrons para ambos ficarem estáveis. O oxigênio, por exemplo, tem 6 elétrons na última camada e precisa de ganhar 2 para se estabilizar. Há os que têm acima de 8, então precisarão perder.
A camada de valência é a que está mais distante do centro e, por isso, é a que está menos “presa” pela força do núcleo. É nessa camada que haverá a primeira a movimentação de elétrons em uma reação, pois tem mais liberdade.
- São mais de 200 resumos gratuitos no Instagram do Beduka. Aproveite!
Propriedades da Tabela periódica
O último ponto que precisamos ter noção para continuar é sobre como a tabela periódica é organizada. Ao longo dos anos, os cientistas foram catalogando os elementos e suas propriedades, então os organizaram na tabela.
De modo resumido, temos que a tabela é dividida em períodos (linhas, horizontal) que correspondem às camadas eletrônicas. Há também as famílias (colunas, vertical) que indicam a valência do elemento.
Os elementos foram dispostos de uma forma estratégica, que nos permite identificar como cresce ou decresce certa propriedade química nos elementos da tabela.
Agora que já temos o básico, vamos entender o que é Afinidade Eletrônica e como ela funciona!
O que é Afinidade Eletrônica?
A Afinidade Eletrônica, também chamada de Eletroafinidade, pode ser entendida como a quantidade de energia liberada por um átomo ao receber ou perder um elétron.
Você se lembra que os átomos mantêm sua estrutura por causa das forças? Sendo assim, para perder ou ganhar um elétron, ele precisa gastar ou absorver energia para ter esse trabalho de incorporar ou expulsar um elétron.
Por isso, a Eletroafinidade é medida em quilojoule por mol (kj/mol) ou elétron-volt (eV).
Como estamos falando em um mundo molecular, é muito recente que essas medições foram feitas e outras foram deduzidas por teorias. Essas medições foram feitas considerando que os átomos estavam sozinhos e no estado gasoso.
A equação a seguir representa essa propriedade:
X(g) + e → X-(g) + energia
Como saber a Afinidade Eletrônica na Tabela Periódica?
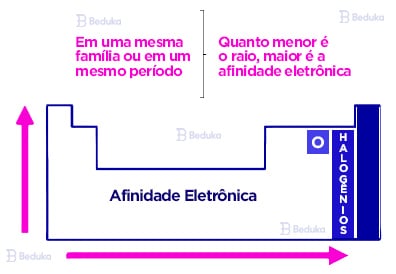
A Eletroafinidade é uma propriedade periódica. Isso significa que ela está relacionada aos números atômicos dos elementos, que são o sentido de organização da tabela periódica.
Assim, podemos identificar uma ordem crescente dessa propriedade nos períodos e grupos da tabela. Em outras palavras, a afinidade eletrônica é maior nos elementos do lado direito e na parte superior da tabela periódica.
Ela cresce no sentido horizontal da esquerda para a direita. No sentido vertical, cresce de baixo para cima.
- Por que é assim?
Os períodos da tabela estão organizados conforme o número atômico (número de prótons). Quanto mais prótons existirem no núcleo, maior será a força de atração que o núcleo exerce nos elétrons da periferia.
Para romper essa força contínua, é preciso gastar ou absorver muita energia. Por isso, no período, a afinidade eletrônica cresce da esquerda para a direita, sendo diretamente proporcional ao número atômico.
Na família, os elementos estão organizados em ordem crescente de números de camadas, de cima para baixo.
Os elementos localizados acima um do outro apresentam menor número de níveis em seus átomos, o que favorece uma maior força de atração do núcleo. Assim, em uma família da Tabela Periódica, a afinidade eletrônica cresce de baixo para cima.
Raio Atômico e Eletroafinidade
Você pode estar se perguntando porque ter menos camadas faz com que a força do núcleo seja maior sobre os elétrons. A resposta está no raio atômico!
Assim como na Geometria Plana, o raio é a distância de um ponto na borda até o centro. Imagine que colocamos uma vela no centro de um círculo e desenhamos vários outros círculos ao redor, contendo os menores.
Se você pegar um ponto no círculo mais interno e compará-lo com um ponto do círculo mais externo, verá que há uma diferença na intensidade da luz. Quando mais distante da fonte emissora, o efeito vai se espalhando e menor é a sua influência.
O mesmo acontece com a gravidade e até com as forças elétricas que mantém os elétrons orbitando o núcleo. Quanto mais distante do centro (maior o raio), menor é a força que ele sofre.
Sob uma menor força, as camadas externas e de maior raio liberam ou absorvem menos energia. Por isso, a Eletroafinidade é inversa ao Raio Atômico.
Quem tem maior Afinidade Eletrônica?
Depois de entender a periodicidade da Eletroafinidade, podemos dizer que a família dos halogênios (elementos do grupo 7A) são os que possuem maiores valores de afinidade eletrônica. Já os metais do grupo 1A (alcalinos), são os de menor valor.
O Cloro (Cl) é o elemento que possui o maior valor absoluto de Afinidade Eletrônica.
A afinidade eletrônica dos gases nobres é irrelevante, pois eles não conseguem receber elétrons (já são estáveis, tem 8 e-) e, por isso, não liberam energia.
Porque o Flúor não tem maior Afinidade Eletrônica?
Se você é um entendedor de tabelas periódicas, deve ter reparado que o elemento mais à direita e mais acima, sem ser gás nobre, é o Flúor (F). Mas, nós dissemos que o Cloro é o elemento com maior eletroafinidade. Como pode?
Acontece que o flúor tem maior dificuldade no ato de receber um elétron do que o cloro. Isso porque ele possui um pequeno tamanho que dificulta a acomodação do elétron recebido.
Sim, é por esse pequeno detalhe que o Cloro “pegou” o primeiro lugar.
Por que a Afinidade Eletrônica pode ser positiva ou negativa?
Para finalizar o assunto, precisamos saber o porquê da Eletroafinidade poder aparecer com valores negativos e positivos. Vamos lá!
O sinal de positivo ou negativo que antecede o valor numérico da Afinidade Eletrônica não é um valor absoluto, mas um símbolo. Ele indica se a energia foi liberada ou absorvida.
- A Afinidade Eletrônica positiva indica que a energia foi liberada quando um átomo ligou-se a um elétron. Pense que, quanto mais estável um átomo for, mais energia ele precisará liberar para que caiba a energia do novo elétron que entrará.
- A afinidade eletrônica negativa indica que foi preciso absorver energia para que um elétron se ligasse ao átomo. Quanto mais negativa (sinal de oposto) essa afinidade for, mais elétrons são atraídos pelos átomos porque é preciso absorver energia.
Diferença entre Afinidade Eletrônica, Energia de ionização e Eletronegatividade
Tanto a Afinidade Eletrônica como a Energia de Ionização e a Eletronegatividade são propriedades periódicas. As diferenças entre termos são:
- Afinidade eletrônica: é a energia liberada com o recebimento de um elétron por um átomo.
- Energia de ionização: ou Potencial de ionização, é a energia necessária para retirar um elétron de um átomo.
- Eletronegatividade: quão forte é a atração dos átomos pelos elétrons, tendência em ganhá-los.
Gostou do nosso artigo sobre Afinidade eletrônica? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet, e o melhor: totalmente gratuito!
Queremos te ajudar a encontrar a FACULDADE IDEAL! Logo abaixo, faça uma pesquisa por curso e cidade que te mostraremos todas as faculdades que podem te atender. Informamos a nota de corte, valor de mensalidade, nota do MEC, avaliação dos alunos, modalidades de ensino e muito mais.
Experimente agora!