Uma Molécula é um conjunto de átomos, sejam eles de elementos iguais ou diferentes. É uma ligação covalente que os une para formar esse agrupamento. Essas espécies químicas são eletricamente neutras e, em conjunto, formam substâncias. Existem diferentes tipos de moléculas, como simples ou macro. O gás oxigênio e o diamante são exemplos.
Neste artigo sobre Moléculas, você encontrará:
- O que são Moléculas + exemplos
- Diferença entre Átomos, Elementos, Substâncias e Moléculas
- O que é Ligação Covalente, como ocorre e tipos
- Tipos de Moléculas: macro, pequenas, polares, apolares, substâncias
- Geometria Molecular
- Estudando para as provas? Conheça O melhor Simulado do Brasil! Ele pode ser personalizado com as matérias que você mais precisa!
O que são moléculas? (Conceito e Exemplos)
Dizemos que uma molécula é o conjunto de átomos. Esse agrupamento pode ser formado por átomos de elementos iguais ou diferentes.
Exemplos
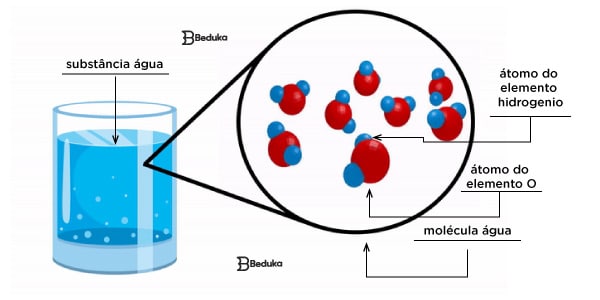
- Molécula de água (H2O): formada por dois elementos diferentes (O e H), sendo dois átomos de Hidrogênio e um de Oxigênio.
- Molécula de Cloro (Cl2): formada por apenas um elemento químico (Cl), sendo dois átomos de Cloro.
- Molécula de Sacarose (C12H22O11): formada por três elementos (C, H e O), sendo 12 átomos de Carbono, 22 átomos de Hidrogênio e 11 átomos de Oxigênio.
Além disso, é importante destacar que a ligação que une esses átomos é do tipo covalente. Por isso, as moléculas são eletricamente neutras e podem formar substâncias (a sacarose forma o açúcar).
Qual a diferença entre molécula, átomo e substância?
Tem muita informação no conceito e você ficou perdido?
Calma!
Os átomos são a menor unidade da matéria, tudo é feito por eles microscopicamente. Os elementos são os materiais da natureza e cada átomo corresponde a um determinado elemento.
O conjunto de elementos forma uma molécula e o conjunto de moléculas forma uma substância. Por fim, o conjunto de diferentes substâncias formam misturas!
Para entender melhor, pense no ar atmosférico:
Há átomos do elemento oxigênio (O) que formam a molécula de Oxigênio (O2). As moléculas de O2 formam uma substância gasosa, chamada gás oxigênio (O2 g). Mas o ar não tem só esse gás, ele também contém N2 g e outros. Por isso, o ar é uma mistura!
Agora, vamos relembrar as definições separadamente e aprofundar nelas.
Átomos
O átomo é a unidade básica da matéria, isso significa que tudo o que conhecemos é formado por um certo número de átomos.
Ao longo do tempo, os estudos foram aprofundando e hoje conhecemos os modelos atômicos. Cada átomo é composto por um número de elétrons, prótons e nêutrons.
Elementos químicos
Os elementos são aqueles que normalmente encontramos na natureza, é o nome dos materiais que formam as coisas.
Exemplos: Hidrogênio, Carbono, Oxigênio, Ouro, Cobre, Cálcio, Ferro, Prata, Cloro, Iodo e Flúor.
Você pode encontrar todos os outros na Tabela Periódica!
Se você lembrar que tudo o que conhecemos é feito de átomos, conseguimos ver a diferença entre um átomo do elemento hidrogênio e um átomo do elemento cobre por causa da quantidade de prótons, elétrons e nêutrons.
Substâncias
Na química, uma substância é toda matéria com forma constante e suas próprias proporções. Ela apresenta propriedades específicas quando passa pelos fenômenos físicos ou químicos. Elas ainda podem ser formadas por íons, átomos ou moléculas.
Um exemplo de substância formada por moléculas é a água (moléculas H20).
Ligação Covalente
Agora que já entendemos que as moléculas são um conjunto de átomos de diferentes ou iguais elementos, podemos entender como todas as partes se unem.
Na química, dizemos que os átomos podem se unir por um dos 3 tipos de ligações Químicas:
- Quando os átomos se unem por ligações iônicas, o resultado é um íon.
- Quando se unem ligações metálicas, o resultado é uma liga metálica.
- Quando se unem por ligações covalentes, o resultado é uma molécula!
Vamos lembrar de outros conceitos importantes antes de continuar:
- Os metais são aqueles elementos da tabela periódica com características bem específicas, como refletir luz, conduzir eletricidade e aquilo que já sabemos do dia a dia.
- Os ametais são aqueles elementos que não são metais e também não são gases nobres.
- Os gases nobres são elementos que não reagem com nenhum outro elemento, já estão em equilíbrio. Na linguagem química significa ser estável, ou seja, ter todas as forças harmonizadas dentro do átomo.
Quase todos os elementos (independente de ser ametal ou metal) só atingem estabilidade quando têm 8 elétrons na camada de valência, ficando com a mesma configuração eletrônica que a dos gases nobres.
Essa é a Regra do Octeto, mas o hidrogênio é uma exceção: ele fica bem com 2.
O que é camada de valência?
Os átomos têm a forma de um “sistema solar”, no meio há prótons e ao redor os elétrons. Cada “órbita” de elétrons é chamada de camada ou nível eletrônico.
Cada camada tem um limite de números de elétrons que ali cabem. O que é importante saber agora é que a valência é dada pelo número de elétrons na última camada de um átomo, independente de ela estar completa ou não.
Essa camada está mais distante do núcleo. Assim, se aquele átomo tiver que perder, ganhar ou compartilhar algo para cumprir a Regra do Octeto, é nessa camada que as coisas mudarão.
Como acontece a ligação covalente?
A ligação Covalente acontece entre ametais, ou seja, os que vão da coluna 3A (família do Boro) até 7A (Halogênios), incluindo ainda o Hidrogênio e os semimetais.
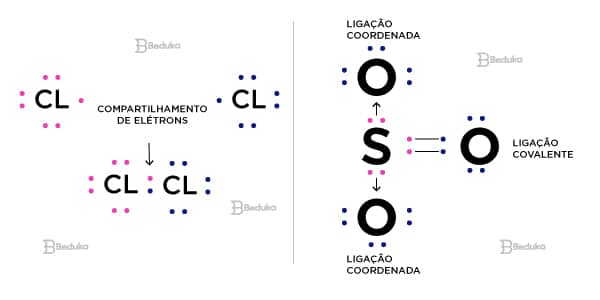
Esse tipo de ligação é marcada pelo compartilhamento de elétrons. Os elétrons compartilhados são aqueles que estão na camada mais externa do átomo (valência).
Assim, os átomos de elementos formam moléculas porque compartilham seus elétrons na última camada, a fim de ficarem estáveis.
Podemos citar uma diferenciação entre as ligações covalentes:
- Ligação covalente molecular: ocorre o compartilhamento do par de elétrons dos dois átomos ligantes.
- Ligação covalente coordenada (dativa): os elétrons compartilhados vem apenas de um dos átomos envolvidos.
Geometria molecular
Para determinar a geometria molecular, devemos considerar a teoria da repulsão dos pares eletrônicos, na camada de valência.
Ela se baseia na ideia de que os pares eletrônicos se comportam como nuvens eletrônicas. Como nuvens, podem se repelir e tentam ter a maior distância angular possível. (Lembre-se: na química, os opostos se atraem e os iguais se repelem).
Quando uma molécula se forma, os átomos se posicionam para encontrar uma distância simétrica entre eles. Isso acontece porque buscam uma disposição mais estável.
Assim, dependendo do número de átomos e das eletronegatividades deles, os compostos apresentam diferentes geometrias.
Observe na imagem acima que elas podem ter geometria Linear, Angular, Triangular, piramidal, tetraédrica ou octaédrica.
Quais são os tipos de moléculas?
São várias as classificações e nomes que podemos incluir nas moléculas, normalmente quanto número de átomos e a sua polaridade.
Vamos estudar cada uma delas individualmente para você entender bem:
Molécula polar
Essas moléculas possuem um polo negativo e outro positivo. Apesar de serem eletricamente estáveis, elas podem ter polos de concentração da eletronegatividade por causa de certos elementos que a compõem.
A eletronegatividade é a tendência de atrair elétrons de outros átomos (quer reagir).
Isso significa que existe uma parte da molécula que tende mais a ser mais negativa do que positiva e vice-versa. Isso varia de acordo com o elemento que a forma.
Uma molécula de água é polar porque o oxigênio é mais negativo que os hidrogênios e sua geometria é angular.
Molécula apolar
Essas moléculas não possuem diferença de eletronegatividade. Normalmente, isso acontece por:
- Serem formadas por átomos com os mesmos elementos.
- Apresentar geometria linear.
Observe que o dióxido de carbono (CO2) é apolar mesmo tendo elementos diferentes, por causa da sua geometria linear. Sendo nivelada, a atração entre os elétrons se anulam.
Moléculas discretas ou simples
São aquelas moléculas formadas por um número pequeno ou restrito de átomos. Costumamos encontrá-las no estado gasoso e também no condensado, além de serem comuns no nosso dia a dia.
Exemplo delas são os gases atmosféricos CO2, O2, N2, etc.
Macromoléculas

As macromoléculas são “estruturas gigantes” que não conseguimos definir um valor para o número de massa, porque são formadas por inúmeros átomos.
Também são conhecidas como sólidos covalentes ou sólidos de rede covalente, porque formam retículos tridimensionais como os cristais covalentes ou cristais atômicos.
Elas costumam estar no estado condensando, sendo sempre polares para conseguir manter essa estrutura.
Os átomos de carbono podem formar diversas macromoléculas diferentes, essa propriedade é chamada de alotropia. Duas variedades alotrópicas do carbono que formam macromoléculas são o diamante e a grafita.
Mas nem todas as macromoléculas são formadas apenas por um elemento.
Exemplo é o dióxido de silício (quartzo), cujas macromoléculas possuem cada átomo de silício rodeado por quatro átomos de carbono e cada átomo de oxigênio ligado a dois átomos de silício.
Outros compostos complexos são as buckyballs, formadas por 60 átomos de carbono ligados em formato de esfera)! Elas são as maiores moléculas já encontradas no espaço.
Substância Molecular
Quando as substâncias são moleculares simples (formadas por um mesmo tipo de moléculas / elemento químico), podemos classificá-las de acordo com a quantidade de átomos:
- Monoatômicas (um átomo): hélio (He) e neon (Ne)
- Diatômicas (dois átomos): gás hidrogênio (H2) e gás flúor (F2)
- Triatômicas (três átomos): gás ozônio (O3)
As substâncias moleculares possuem algumas características próprias:
- Solubilidade variada em água e em outros solventes
- Podem se apresentar nos três estados físicos
- De modo geral, são isolantes elétricos no estado sólido e no líquido (a água só conduz quando está associada com sais)
- Quanto mais intensa for a atração entre as moléculas, maior será a temperatura de ebulição.
- Quanto maior for a substância maior será sua superfície de contato, devido ao aumento das interações entre as moléculas, a temperatura de ebulição irá aumentar.
Gostou do nosso artigo sobre Moléculas? Confira outros artigos do nosso blog e se prepare para o Enem da melhor maneira! Você também pode se organizar com o nosso plano de estudos, o mais completo da internet!





